微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 要证明CO2中混有的SO2气体,不能选用的试剂是
A.澄清石灰水
B.品红溶液
C.溴水
D.酸性KMnO4溶液
参考答案:A
本题解析:
SO2和CO2都属于酸性氧化物,它们都能使澄清石灰水变浑浊,所以不能利用澄清石灰水来区别SO2和CO2,选A。SO2还具有漂白性,能使品红溶液褪色,而CO2没有此性质,所以能利用品红溶液溶液区别SO2和CO2;SO2也具有还原性,能被溴水氧化(溶液褪色),而CO2没有此性质,所以能利用溴水区别SO2和CO2;SO2具有还原性,能被KMnO4酸性溶液氧化(溶液褪色),而CO2没有此性质,所以能利用KMnO4酸性溶液区别SO2和CO2。
本题难度:一般
2、选择题 .三组混合液:①植物油和水;②乙醇和水;③氯化钠和单质碘的混合水溶液,分离它们的正确方法依次是(?)
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
参考答案:C
本题解析:分液适用于液液互不相溶的分离和提纯;蒸馏适用于互溶的液体分离和提纯;
①植物油和水用分液;②乙醇和水用蒸馏;③氯化钠和单质碘的混合水溶液用萃取;
本题难度:简单
3、实验题 (15分)大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程:
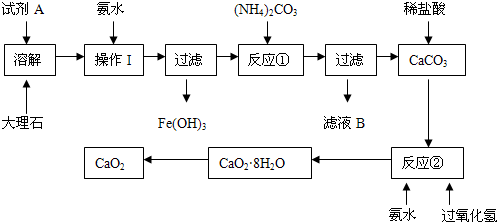
请回答下列问题:
(1)试剂A的名称是?;
(2)操作I的目的是?;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有?;
(4)写出反应②中生成CaO2·8H2O的化学方程式:?;
(5)制得的CaO2中一般含有CaO该化学兴趣小组通过实验测定制得的样品中CaO2的含量:称量0.6g样品于锥形瓶中,然后加入过量的浓度为2.00mol?L-1的盐酸20.00mL,再用浓度为2.00mol?L-1的氢氧化钠溶液滴定锥形瓶中的溶液,消耗氢氧化钠溶液11.00mL.该样品中CaO2的质量分数为?。
参考答案:(1)硝酸或盐酸;?(2)调节溶液的pH,使Fe3+完全沉淀;(3)搅拌和引流;
(4)CaC12?+ H2O2?+ 2NH3?+ 8H2O ═ CaO2·8H2O↓ + 2NH4Cl?;(5)72%。
本题解析:CaCO3能与稀HCl或稀硝酸发生反应,转化为可溶性物质,而硫酸与CaCO3反应产生的硫酸钙微溶于水,使反应不能继续进行。而Fe2O3能与酸反应得到可溶性的铁盐,因此试剂A是硝酸或盐酸;(2)向其中加入氨水的目的是调节溶液的pH,使Fe3+完全沉淀;然后过滤除去。(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有促进固体溶解的搅拌和为了分离难溶性固体与可溶性溶液的分离混合物的引流作用;(4)反应②中由CaCO3与H2O2?和氨水反应生成CaO2·8H2O的化学方程式是:CaC12?+ H2O2?+ 2NH3?+ 8H2O ═ CaO2·8H2O↓ + 2NH4Cl?;(5)n(HCl)= 2.00mol/L×0.02L=0.04mol。n(NaOH)=n(HCl)(过量)= 2.00mol/L×0.011L-0.022mol。因此样品产生的OH-的物质的量为0.018mol.。设样品中含有CaO2、CaO的物质的量分别x、y。则2x+2y=0.018mol;72x+56y=0.6g。解得x=0.006mol;y=0.003mol。所以该样品中CaO2的质量分数为[(0.006mol×72g/mol)÷0.6]×100%=72%。
本题难度:一般
4、选择题 设NA为阿伏加德罗常数的值,下列有关说法不正确的是
A.标准状况下,48gO3含有的氧原子数是3NA
B.含107gFe(OH)3的胶体中胶粒总数是NA
C.0.5L0.2mol?L-1的NaCl溶液中含有的Na+是0.1NA
D.标准状况下,33.6LCO中含有的原子数是3NA
参考答案:B
本题解析:分析:A、根据n= 计算氧原子物质的量,再根据N=nNA计算氧原子数目.
计算氧原子物质的量,再根据N=nNA计算氧原子数目.
B、Fe(OH)3的胶体中胶粒是Fe(OH)3集合体.
C、根据n=cV计算钠离子的物质的量,再根据N=nNA计算钠离子数目.
D、根据n= 计算一氧化碳的物质的量,再根据N=nNA计算原子数目.
计算一氧化碳的物质的量,再根据N=nNA计算原子数目.
解答:A、标准状况下,48gO3含有的氧原子数为 ×3×NAmol-1=3NA,故A正确;
×3×NAmol-1=3NA,故A正确;
B、Fe(OH)3的胶体中胶粒是Fe(OH)3集合体,故B错误;
C、0.5L0.2mol?L-1的NaCl溶液中含有的Na+是0.5L×0.2mol?L-1×NAmol-1=0.1NA,故C正确;
D、标准状况下,33.6LCO中含有的原子数是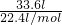 ×2×NAmol-1=3NA,故D正确.
×2×NAmol-1=3NA,故D正确.
故选:B.
点评:考查常用化学计量数的有关计算,难度较小,注意胶体中胶粒是许多粒子集合体.
本题难度:简单
5、选择题 下列各组仪器:①漏斗?②容量瓶?③滴定管?④分液漏斗?⑤天平?⑥量筒?⑦胶头滴管?⑧蒸馏烧瓶。常用于物质分离的是
A.①③⑦
B.②⑥⑦
C.①④⑧
D.④⑥⑧
参考答案:C
本题解析:漏斗一般用于过滤、分液漏斗一般用于分液、蒸馏烧瓶用于蒸馏,故选C
本题难度:一般