| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《有关氧化还原反应的计算》高频试题巩固(2017年最新版)(八)
(2)目前已开发出用电解法制取ClO2的新工艺。 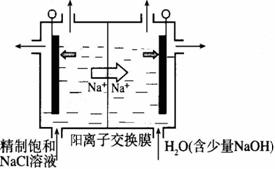 ①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。 ②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 。 (3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含 CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为 。 参考答案:(1)①B (1分) ② 0.1 (1分) 本题解析:(1)①4HCl中2HCl转化为Cl2,表现还原性,2HCl转化为NaCl,表现酸性,故B项正确。 本题难度:困难 2、简答题 实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl═MnCl2+Cl2↑+2H2O,欲制得标准状况下4.48L氯气, 参考答案:(1)标准状况下4.48LCl2的物质的量为:4.48L22.4L/mol=0.2mol,则: 本题解析: 本题难度:一般 3、选择题 逻辑推理是化学学习常用的思维方法。下列推理正确的是 参考答案:A 本题解析: 本题难度:简单 4、选择题 下列有关化学用语表示正确的是 参考答案:B 本题解析:A.不能省略官能团碳碳双键,正确的写法是CH2=CHCHO;C、氮气分子的电子式::N┇┇N:;D.Mg2+的结构示意图中只有两个电子层,最外层是8,,错误; 本题难度:一般 5、选择题 已知:还原性强弱:I—>Fe2+。往100 ml碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为 |
参考答案:C
本题解析:碘化亚铁溶液中存在I—、Fe2+,由于还原性强弱:I—>Fe2+,故缓慢通入3.36 L(标准状况)氯气,Cl2先与I—反应:2I—+ Cl2=I2+2Cl-,再与Fe2+反应:2Fe2++Cl2=2Fe3++2Cl-,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+,故可设原碘化亚铁溶液的物质的量浓度为xmol/L,根据得失电子守恒可知:0.1L×2xmol/L+0.1L×0.5xmol/L=0.3mol,得x=1.2mol·L—1,故C项正确。
考点:氧化还原反应计算。
本题难度:一般
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点总结《物质组成与.. | ||