微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组性质的比较中正确的是

A.酸性: HClO4<HBrO4<HIO4
B.碱性强弱: KOH > NaOH > LiOH

C.稳定性: PH3>H2S>H Cl
D.氧化性: I2>Br2>Cl2
参考答案:B
本题解析:A错误,最高价含氧酸酸性随中心元素的非金属性增强而增强,所以正确的应该是
HClO4〉HBrO4〉HIO4
B正确,碱性强弱与金属的金属性有关,金属性越强,其形成的碱,碱性越强。
C错误,氢化物稳定性与元素的非金属性有关,非金属性越强,氢化物越稳定,HCl是三种物质中最稳定的。
D错误,正确的为:Cl2>Br2>I2
本题难度:一般
2、选择题 下列事实中,能说明氯元素原子得电子能力比硫元素原子强的是(?)
①HCl的溶解度比H2S大②盐酸的酸性比氢硫酸(H2S水溶液)酸性强③HCl的稳定性比H2S强④HCl的还原性比H2S强⑤HClO的酸性比H2SO4强⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS⑦Cl2能与H2S反应生成S⑧在元素周期表中Cl处于S同周期的右侧⑨还原性Cl-<S-
A.③⑥⑦⑧⑨
B.③④⑤⑦⑧⑨
C.③⑥⑦⑧
D.①②③④⑤⑥⑦⑧⑨
参考答案:A
本题解析:略
本题难度:简单
3、填空题 (11分) 元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(7)?第VIA族元素形成的气态氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(8)?第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为?;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为?。?(表1)
氢化物
| A
| B
| HF
| D
| E
|
沸点/℃
| 1317
| 100
| 19.5
| 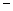 33.35 33.35
| 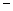 164 164
|
(9)?第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(10)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为?。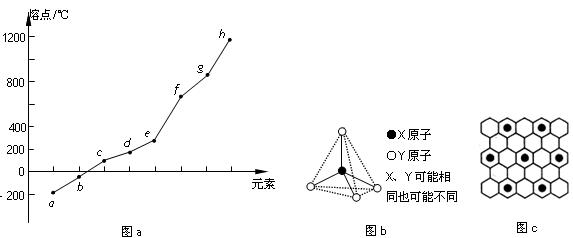
参考答案:(11分)
(1) H2O(1分)? H2O分子间可以形成氢键(1分)?角型或折线型(1分)
(2) CH4(1分)? Si(1分)? (3) 30(2分)? (4) 石墨(1分)? KC8(3分)
本题解析:略
本题难度:简单
4、填空题 36 g H2O与80 g D2O的物质的量之比是_ _____,分子中所含质子数之比是________,所含中子数之比是____?___,它们分别与Na反应时,所放出气体体积之比(同条件下)是________,质量之比是________。(10分)
参考答案:1:2? 2:5? 1:2? 1:4
本题解析:略
本题难度:简单
5、选择题 下表为元素周期表前四周期的一部分,下列有关表中各元素的叙述正确的是
A.原子半径的大小顺序是①>②>③>④
B.氢化物的沸点:⑤高于④
C.氢化物的稳定性:⑦比⑥强
D.最高价氧化物对应水化物的酸性:②比③强
参考答案:D
本题解析:
根据元素在周期表中的位置,①②③④⑤⑥⑦分别代表Si、N、P、O、S、Cl、Br元素.A项,原子半径:①>③>②>④;B项,H2O分子间存在氢键,沸点H2O>H2S;D项,非金属性Cl>Br,稳定性HCl>HBr.正确答案为C。
本题难度:一般