微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语使用正确的是
A.Mg2+结构示意图: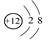
B.含18个中子的氯原子的核素符号: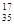 Cl
Cl
C.苯甲醛: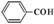
D.水合氢离子电子式: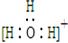
参考答案:A
本题解析:A、Mg2+核外电子数为10,结构示意图正确;B、质子数在元素符号的左下方、质量数在元素符号的左上方,错误;C、醛基的结构简式为—CHO,错误;D、水和氢离子中,O与3个H形成了3个共价键,O还有1对孤对电子,错误。
本题难度:一般
2、简答题 现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L?(标准状况).
(1)该反应的离子方程式为______.
(2)则选用所贴标签为2.0mol-L-1的氢氧化钠,至少需该氢氧化钠溶液______毫升.
(3)如选用所贴标签为10%(密度为1.043g-mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸______毫升(保留小数点后一位).
参考答案:(1)氯气与氢氧化钠反应生成氯化钠、次氯酸钠、与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)标况下4.48L氯气的物质的量为4.48L22.4L/mol=0.2mol,根据方程式Cl2+2OH-=Cl-+ClO-+H2O可知,参加反应的NaOH的物质的量为0.2mol×2=0.4mol,故需要氢氧化钠溶液的体积为0.4mol2mol/L=0.2L=200mL,
故答案为:200;
(3)中和氢氧化钠,恰好反应需要盐酸的体积最少,此时n(HCl)=n(NaOH)=0.4mol,
该盐酸的物质的量浓度为1000×1.043×10%36.5mol/L=2.858mol/L,
故需要盐酸的体积为0.4mol2.858mol/L=0.14L=140.0mL,
故答案为:140.0.
本题解析:
本题难度:一般
3、选择题 下列有关化学用语表示正确的是(?)
A.H3O+的电子式: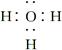
B.—NH2的电子式: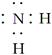
C.NaHS显碱性的原因:HS-+H2O S2-+H3O+
S2-+H3O+
D.乙烷的二氯代物有两种(不考虑立体异构)
参考答案:D
本题解析:A项应为 ;B项应为
;B项应为 ;C项应为HS-+H2O
;C项应为HS-+H2O H2S+OH-;D项,C2H6的二氯代物同分异构体为
H2S+OH-;D项,C2H6的二氯代物同分异构体为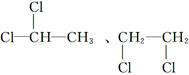 。
。
本题难度:一般
4、选择题 下列叙述正确的是
A.聚丙烯的结构简式为: CH2-CH2-CH2
CH2-CH2-CH2
B.CO2分子的电子式为
C.在CS2、PCl3中各原子最外层均能达到8电子的稳定结构
D.Ar原子的结构示意图为:
参考答案:C
本题解析:A:聚丙烯的结构简式为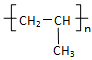
B:CO2分子的电子式为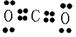
C:正确
D:Ar原子核内有18个质子,不正确
本题难度:简单
5、计算题 (本题共14分)
溴化钠是工业提溴的中间产物,也是重要的化工生产原料,回答下列问题。
56.工业上用氯气氧化卤水中的溴离子,吹出溴蒸气后用10% 的纯碱溶液吸收,反应的化学方程式为:
3Na2CO3+ 3Br2 → 5NaBr + NaBrO3 + 3CO2若生成标准状况下3.36 L CO2,吸收的Br2为________g。
57.吹出的溴蒸气中会含有少量未反应的氯气,用纯碱吸收后实际生成的是NaCl、NaBr和NaBrO3。若所得溶液中含0.1 mol NaCl与0.6 mol NaBr,则溶液中NaBrO3的物质的量为_______mol。
58.将纯碱吸收后所得的溶液浓缩,加入2 mol/L H2SO4后蒸馏可以回收纯溴:
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4+ 3Br2↑+ 3H2O
已知向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠。若改为加入180 mL硫酸,计算可回收的液溴的质量。
59.向0.3 mol NaBr固体中加入足量浓硫酸并微热,产生的气体呈红棕色,且残留物中不含溴元素。将所得气体通入280 mL 2 mol/L的Na2SO3溶液中,无任何气体逸出,最终得到只含NaBr、Na2SO4和NaHSO3三种溶质的无色溶液。求红棕色气体中各组分的化学式与物质的量。
参考答案:56.24g(3分) 57.0.14(3分) 58.43.2(4分)(给过程分)
59.Br2 0.13 mol、SO2 0.13 mol、HBr 0.04 mol(4分,三种成分判断正确2分,物质的量都对2分)
本题解析:56.根据反应方程式可知:n(Br2)=n(CO2)=" 3.36" L÷22.4L/mol=0.15mol;所以m(Br2)= 0.15mol×160g/mol=24g;
57.根据反应过程中电子转移数目相等可知:n(e-)="0.1" mol×1+0.6 mol×1=0.7mol,所以n(NaBrO3)= 0.7mol÷5=0.14mol;
58.向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠,说明溶液中的NaBr和NaBrO3完全转化为Br2。n(NaBr)+n(NaBrO3)=2n(H2SO4)="2×(2" mol/L×0.3mol)=1.2mol.n(Br2)=" 81.6" g÷160g/mol=0.51mol,说明在溶液则溶解Br2的物质的量是1.2mol÷2-0.51mol=0.09mol。若改为加入180 mL硫酸,则硫酸不足量产生的溴单质按照硫酸来计算。n(H2SO4)= n(Br2)="0.18L×2" mol/L=0.36mol,在溶液中溶解的溴单质的物质的量是0.09mol。所以可回收的液溴的质量是(0.36mol-0.09mol) ×160g/mol=43.2g。
59.由于产生的红棕色的气体且残留物中不含溴元素,则溴元素完全转化为Br2,该红棕色气体中有Br2,NaBr与足量浓硫酸反应的方程式是:2NaBr+2H2SO4(浓)  Na2SO4+SO2↑+H2O。可见n(Br2)=n(SO2).若Br元素完全被氧化为Br2,根据Br元素守恒可得n(Br2)=" 0.3" mol÷2=0.15mol。NaBr被浓硫酸氧化,则浓硫酸钡还原变为SO2,根据氧化还原反应中电子转移数目相等可知, n(SO2)=0.15mol,n(Br2):n(SO2)= 1:1.将气体通入溶液中,且无气体逸出,则根据方程式Br2+Na2SO3+H2O → Na2SO4 +2HBr;SO2 + Na2SO3→ 2NaHSO3;HBr + Na2SO3→ NaHSO3 +NaBr可知需要消耗0.60mol 的Na2SO3>0.56mol,故说明在气体中除Br2、SO2外,还有HBr。设气体中Br2为x mol,则HBr为(0.3-2x)mol,SO2为x mol,则根据方程式Br2+Na2SO3+H2O → Na2SO4 +2HBr可知Br2反应消耗的Na2SO3的物质的量是x,SO2 + Na2SO3→ 2NaHSO3中SO2反应消耗的Na2SO3的物质的量是x,整个溶液包括反应产生的HBr和原混合气体中的HBr共0.3mmol发生反应HBr + Na2SO3→ NaHSO3 +NaBr消耗的Na2SO3的物质的量是0.3mol,所以x + 0.3 + x=0.56 解得x=0.13mol,因此n(Br2)= n(SO2)= 0.13mol;n(HBr)= 0.04mol。
Na2SO4+SO2↑+H2O。可见n(Br2)=n(SO2).若Br元素完全被氧化为Br2,根据Br元素守恒可得n(Br2)=" 0.3" mol÷2=0.15mol。NaBr被浓硫酸氧化,则浓硫酸钡还原变为SO2,根据氧化还原反应中电子转移数目相等可知, n(SO2)=0.15mol,n(Br2):n(SO2)= 1:1.将气体通入溶液中,且无气体逸出,则根据方程式Br2+Na2SO3+H2O → Na2SO4 +2HBr;SO2 + Na2SO3→ 2NaHSO3;HBr + Na2SO3→ NaHSO3 +NaBr可知需要消耗0.60mol 的Na2SO3>0.56mol,故说明在气体中除Br2、SO2外,还有HBr。设气体中Br2为x mol,则HBr为(0.3-2x)mol,SO2为x mol,则根据方程式Br2+Na2SO3+H2O → Na2SO4 +2HBr可知Br2反应消耗的Na2SO3的物质的量是x,SO2 + Na2SO3→ 2NaHSO3中SO2反应消耗的Na2SO3的物质的量是x,整个溶液包括反应产生的HBr和原混合气体中的HBr共0.3mmol发生反应HBr + Na2SO3→ NaHSO3 +NaBr消耗的Na2SO3的物质的量是0.3mol,所以x + 0.3 + x=0.56 解得x=0.13mol,因此n(Br2)= n(SO2)= 0.13mol;n(HBr)= 0.04mol。
考点:考查工业上从海水中的NaBr获得溴单质的方法、回收过程中产生的气体的成分的确定、守恒方法在回收的物质的质量的计算的应用的知识。
本题难度:困难