| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《离子共存》高频考点预测(2017年最新版)(六)
参考答案:B 本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A.能使甲基橙变红的溶液显酸性,在酸性溶液中硝酸根能氧化Fe2+与S2-,不能大量共存,A错误;B.pH=11的溶液显碱性,则Na+、AlO2—、NO3—、S2-、SO32—之间不反应,可以大量共存,B正确;C.室温下,由水电离的c(H+)=10-10mol/L的溶液中水的电离被抑制,溶液可能显酸性,也可能显碱性,如果显酸性,则碳酸氢根、氟离子不能大量共存。如果显碱性,则碳酸氢根与铵根离子均不能大量共存,C错误;D.加入Mg能放出H2的溶液显酸性,则ClO-不能大量共存,D错误,答案选B。 本题难度:困难 3、选择题 常温下,下列各溶液中的离子一定能大量共存的是 参考答案:D 本题解析: 本题难度:一般 4、选择题 下列各组离子能在水溶液中大量共存的是 |
参考答案:C
本题解析:A项H+与ClO-不能大量共存,且Fe2+易被氧化,也不能大量存在;B项Cu2+与S2-产生难溶的CuS,而不能大量共存;D项Al3+与SiO32-和CO32-均能发生双水解而不能大量共存。
考点:离子共存问题。
本题难度:一般
5、填空题 (16分)Ⅰ.某无色溶液X,由K+、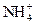 、Ba2+、Al3+、Fe3+、
、Ba2+、Al3+、Fe3+、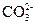 、
、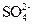 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验:
(1)白色沉淀甲是 。
(2)试写出实验过程中生成气体A、B的离子方程式 & #160; 、 。
(3)通过上述实验,可确定X溶液中一定存在的离子是 ,要确定可能存在的离子,需补加的实验是 。
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。常温下各烧杯中溶液的pH与电 解时间t的关系图如上。据此回答下列问题:
解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”)电极b上发生的电极反应为 。
(2)计算电极e上生成的气体在标准状况下的体积 ;
(3)写出乙烧杯的电解池反应 。
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是 。
参考答案:(16分)
Ⅰ(1)BaSO4(1分)
(2)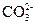 +2H+=CO2↑+H2O(1分)
+2H+=CO2↑+H2O(1分) 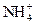 +OH-
+OH-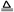 NH3↑+H2O(1分)
NH3↑+H2O(1分)
(3)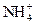 、
、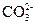 、
、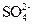 (2分) 做焰色反应,透过蓝色钴玻璃片若火焰呈紫色则含K+,否则不含K+。(2分)
(2分) 做焰色反应,透过蓝色钴玻璃片若火焰呈紫色则含K+,否则不含K+。(2分)
Ⅱ.(1)负(1分);4OH--4e-=2H2O+O2↑ (1分)
(2)5.6L(1分)
(3)2CuSO4+2H2O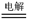 2Cu+O2↑+2H2SO4(2分)
2Cu+O2↑+2H2SO4(2分)
(4)能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应(2 分)
分)
(5)向丙烧杯中加4.5g水(2分)
本题解析:略
本题难度:困难
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高中化学知识点讲解《有关氧化还.. | ||