微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为:
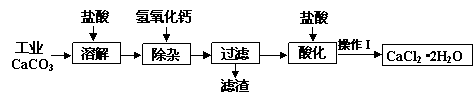
(1)CaCO3与盐酸反应的离子方程式?。
(2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为?,若用氢氧化钠溶液除杂则产品中可能混有的物质为?。
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是?。
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④?⑤?等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL 0.5000 m来源:91考试网 91ExaM.orgol/LAgNO3溶液恰好完全反应。
①样品中CaCl2·2H2O的质量分数为?。
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由?引起的(填序号),理由是?。
实验题 某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为:

(1)CaCO3与盐酸反应的离子方程式?。
(2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为?,若用氢氧化钠溶液除杂则产品中可能混有的物质为?。
(3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是?。
(4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④?⑤?等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL 0.5000 mol/LAgNO3溶液恰好完全反应。
①样品中CaCl2·2H2O的质量分数为?。
②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由?引起的(填序号),理由是?。
本题答案:(1)CaCO3+2H+=Ca2++CO2↑+H2O(1分)
(2)①Al(OH)3、SiO2、Fe(OH)3(1分)NaCl(1分)
(3)除去过量的氢氧化钙(1分,合理则给分);
(4)洗涤;干燥(各1分)
(5)①.102.5﹪(2分)
②.⑤(1分);干燥时温度过高时CaCl2·2H2O 晶体失去部分结晶水(合理则给分)
本题解析:⑴CaCO3与盐酸反应的离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O,答案:CaCO3+2H+=Ca2++CO2↑+H2O;⑵第一次反应的生成物有氯化钙、氯化钠、氯化铁和氯化铝,第二次反应加入过量氢氧化钙溶液,与氯化铁和氯化铝反应生成氢氧化铁沉淀和氢氧化铝沉淀.故滤渣中的主要成份是氢氧化铁沉淀和氢氧化铝沉淀;加入过量氢氧化钙溶液后,不能与氯化钙、氯化钠反应,故滤液中含有氯化钙、氯化钠和剩余的氢氧化钙,加入盐酸,与氢氧化钙反应生成氯化钙,因此最后蒸发结晶后得到的氯化钙中一定含有少量的氯化钠.答案:①Al(OH)3、SiO2、Fe(OH)3(1分)NaCl(1分);⑶酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是除去过量的Ca (OH)2,答案:除去过量的氢氧化钙;⑷从溶液中获得晶体一般要经过①蒸发浓缩②冷却结晶③过滤④洗涤⑤干燥等步骤。答案:洗涤;干燥
⑸①解:设样品中含CaCl2 ·2H2O的质量为Y
根据氯原子守恒得到如下关系式:
CaCl2 ·2H2O?~? 2AgCl
147? 2
Y? 0.2050 L ×0.5000 mol/L
Y="7.5338" g
样品中含CaCl2 ·2H2O的质量分数="7.5338g/7.350g*100%=102" .5%
答:样品中含CaCl2 ·2H2O的质量分数为102.5%
②计算结果明显有误差,产生的原因可能是⑤中干燥时温度过来源:91考试网 91ExAm.org高时CaCl2·2H2O 晶体失去部分结晶水(合理则给分)。
答案:①.102.5﹪(2分)
②.⑤(1分);干燥时温度过高时CaCl2·2H2O 晶体失去部分结晶水(合理则给分)
本题所属考点:【物质的分离、提纯】
本题难易程度:【一般】
Plough deeper and harvest more. 深耕细作,多打粮秣.