微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
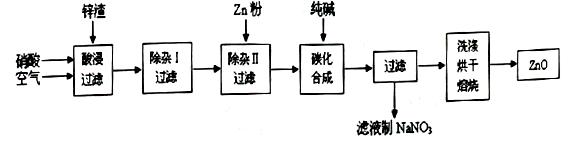
实验题 现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下:
有关氢氧化物完全沉淀的pH见下表:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Zn(OH)2
|
pH
| 5.2
| 3.2
| 9.7
| 6.7
| 8.0
|
?
(l)在酸浸过程中,要提高锌元素的浸出率,可以采取?措施。
(2)上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有?。
(3)在“除杂I”步骤中,将溶液调至pH=4的目的是?。在“除杂II”后,溶液的pH约为6,则此步过滤时滤渣中含有?。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式?。
(5)从滤液中提取NaNO3晶体的操作步骤为?。
(6)在实验室如何洗涤过滤出的碱式碳酸锌??。
实验题 现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下:

有关氢氧化物完全沉淀的pH见下表:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Cu(OH)2
| Zn(OH)2
|
pH
| 5.2
| 3.2
| 9.7
| 6.7
| 8.0
|
?
(l)在酸浸过程中,要提高锌元素的浸出率,可以采取?措施。
(2)上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有?。
(3)在“除杂I”步骤中,将溶液调至pH=4的目的是?。在“除杂II”后,溶液的pH约为6,则此步过滤时滤渣中含有?。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式?。
(5)从滤液中提取NaNO3晶体的操作步骤为?。
(6)在实验室如何洗涤过滤出的碱式碳酸锌??。
本题答案:(16分)
(1)加热、搅拌(2分)
(2)烧杯、玻璃棒、漏斗?(3分)
(3)使Fe3+转化为Fe(OH)3沉淀除去(2分)
Al(OH)3、Cu、Zn?(2分)?(不填Zn不扣分)
(4)2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑(2分)
(5)蒸发浓缩、冷却结晶、过滤(3分)
(6)往漏斗中加入少量蒸馏水,浸没沉淀,让其自然滤出,反复几次(2分)
本题解析:(1)增大反应物浓度、升高温度、增大压强(有气体参加的反应)、增大固体表面积、使用合适的催化剂、研磨、搅拌、振荡等措施,都是加快反应速率、提高浸出率的常用措施;(2)过滤分离固液混合物,常用的玻璃仪器有烧杯、普通漏斗、玻璃棒;(3)硝酸具有强氧化性和强酸性,酸性条件下空气中的氧气也能将亚铁离子氧化为铁离子,则溶液中含有Zn2+、Fe3+、Cu2+、Al3+、H+、NO3-,读表中信息 可知,将溶液pH调至4时,铁离子完全变为氢氧化铁沉淀,可以除去溶液中的铁离子;将溶液pH调至6时,铝离子完全变为氢氧化铝沉淀,可以除去溶液中的铝离子,由于锌比铜活泼,则加入过量的锌不仅能消耗氢离子,而且能将铜离子完全还原为单质铜,既除去杂质,又没有引入新杂质,则除杂II所得滤渣主要成分为氢氧化铝、铜、锌;(4)依题意,加入的碳酸钠与硝酸锌溶液反应,生成碱式碳酸、二氧化碳,根据质量守恒原理可得该复分解反应方程式:2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑;(5)硝酸钠是可溶性盐,溶解度随温度下降而明显减小,根据其性质推断,将滤液蒸发浓缩、冷却结晶、过滤得到硝酸钠晶体;(6)根据过滤之后洗涤沉淀的一般原理,洗涤碱式碳酸锌时,先向漏斗中加入少量蒸馏水,浸没沉淀,再让其自然滤出,反复几次即可。
本题所属考点:【物质的分离、提纯】
本题难易程度:【一般】
Labour is light where love doth pay. 以爱情作报酬,劳苦也轻松.