|
|
|
重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可?【物质的分离、提纯】
2017-05-11 12:02:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
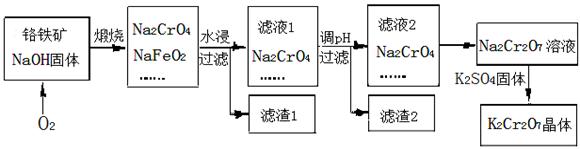
填空题 重铬 酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:
已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O 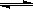 2CrO42- + 2H+ 2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 ?。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ?;
生成滤渣1中红褐色物质的反应离子方程式是 ?。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是:?;
洗涤时应选用 ?(选填字母)。
A.蒸馏水
B.酒精
C.稀硫酸
D.饱和K2SO4溶液
| (5 )工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72— 转化为Cr3+,该反应的离子方程式为?,再调节溶液的pH使金属离子生成沉淀而除去。
填空题 重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:

已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O 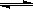 2CrO42- + 2H+ 2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 ?。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ?;
生成滤渣1中红褐色物质的反应离子方程式是 ?。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是:?;
洗涤时应选用 ?(选填字母)。
A.蒸馏水
B.酒精
C.稀硫酸
D.饱和K2SO4溶液
|
(5 )工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72— 转化为Cr3+,该反应的离子方程式为
?,再调节溶液的pH使金属离子生成沉淀而除去。
本题答案:(1)4FeO?Cr2O3 + 7O2 + 20NaOH

8Na2CrO4 + 4NaFeO2— + 10H2O(2分)
(2)NaAlO2、Na2SiO3(2分);? FeO2— + 2H2O=OH —+ Fe(OH)3↓(2分)?
(3)(稀)硫酸(1分)
(4)同温 下K2Cr2O7晶体的溶解度小于Na2Cr2O7,冷却时会结晶析出(2分);?A(1分)
(5)6Fe2+ + Cr2O72— + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O(2分)
本题解析:(2)由题目信息可知,铬铁矿的主要成分FeO?Cr2O3,含有SiO2、Al2O3等杂质,SiO2与NaOH发生反应生成Na2SiO3,Al2O3与NaOH发生反应,生成NaAlO2,故还含有Na2SiO3、NaAlO2。滤渣1中红褐色物质是由于NaFeO2水解生成氢氧化钠与氢氧化铁,反应方程式为NaFeO2+2H2O═NaOH+Fe(OH)3,
(3)由工艺流程可知,Na2CrO4在酸性条件下转化为Na2Cr2O7,故需加入的物质为稀硫酸。
(4)Na2Cr2O7溶液中加入K2SO4固体能够发生复分解反应,说明同温下K2Cr2O7晶体的溶解度小于Na2Cr2O7,便于结晶析出晶体。
本题所属考点:【物质的分离、提纯】
本题难易程度:【一般】
There is no friend so faithful as a good book. 最忠实的朋友莫过于一本好书.
 8Na2CrO4 + 4NaFeO2— + 10H2O(2分)
8Na2CrO4 + 4NaFeO2— + 10H2O(2分)