微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化? 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化? 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
?
| K2CO3
| KHCO3
| K2SO4
| KMnO4
|
溶解度/g
| 111
| 33.7
| 11.1
| 6.34
|
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和?。(填字母)
a.表面皿? b.蒸发皿? c.铁坩埚? d.泥三角
(2)加酸时不宜用硫酸的原因是?;不宜用盐酸的原因是?。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为?。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为?。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中 ,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为?。
②达到滴定终点的标志为?。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度?。(填“偏高”、“偏低”或“无影响”)?
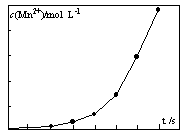
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为?。
填空题 由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化? 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化? 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
?
| K2CO3
| KHCO3
| K2SO4
| KMnO4
|
溶解度/g
| 111
| 33.7
| 11.1
| 6.34
|
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和?。(填字母)
a.表面皿? b.蒸发皿? c.铁坩埚? d.泥三角
(2)加酸时不宜用硫酸的原因是?;不宜用盐酸的原因是?。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为?。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为?。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为?。
②达到滴定终点的标志为?。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度?。(填“偏高”、“偏低”或“无影响”)?
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为?。

本题答案:(1)c d(2)生成K2SO4溶解度小,会降低产品的纯度。盐酸具有还原性,会被氧化,降低产品的量。(3)K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率。(4)①2MnO4―+5C2O42?―+16H+=2Mn2++10CO2↑+8H2O 或MnO4―+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O②锥形瓶中溶液突变为浅红色且半分钟内不褪色。③偏高(1分)④生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
本题解析:(1)进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 c.铁坩埚和d.泥三角。(2)根据表中的数据K2CO3的溶解度是K2SO4的10倍,加酸时生成K2SO4溶解度小,不利于平衡右移,会降低产品的纯度。另外盐酸具有还原性,会被高锰酸钾氧化,降低产品的量。(3)与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率。①C2O42?―有还原性被高锰酸钾氧化为二氧化碳,在酸性溶液中高锰酸钾的还原产物是二价锰离子,滴定过程中反应的离子方程式为①2MnO4―+5C2O42?―+16H+=2Mn2++10CO2↑+8H2O 或MnO4―+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。②由于高锰酸根是紫色溶液,可以通过本身颜色的变化做为终点判断,锥形瓶中一开始是无色溶液,达到滴定终点的标志为锥形瓶中溶液突变为浅红色且半分钟内不褪色。③由于草酸发生了分解,浓度自然减小,测定中用量肯定会增多,计算出高锰酸钾的量增大,会导致测得产品纯度偏高。④从图像中可以看出锰离子的浓度到后来增加程度较大,其原因可能为生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
本题所属考点:【物质的分离、提纯】
本题难易程度:【一般】
A learned man is not learned in everything. 有学问的人并非什么都懂.