微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 用霞石岩(化学式为?KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
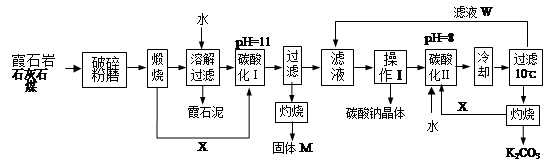
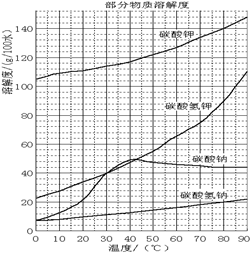
已知:NaHCO3溶液的pH约为8~9,N a2CO3溶液的pH约为11~12。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见右图。
试回答下列问题:
(1)灼烧得到固体M的化学方程式是________________________________。
(2)X物质是___________,滤液W中主要含有的离子有____________。(写三种)
(3)操作Ⅰ得到碳酸钠晶体的操作为 ?、?、?、洗涤、干燥。
(4)碳酸化Ⅰ中发生主要反应的离子方程式是__________________________。
(5)碳酸化Ⅱ调整pH=8的目的是_______________________________。
填空题 用霞石岩(化学式为?KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:

已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见右图。

试回答下列问题:
(1)灼烧得到固体M的化学方程式是________________________________。
(2)X物质是___________,滤液W中主要含有的离子有____________。(写三种)
(3)操作Ⅰ得到碳酸钠晶体的操作为 ?、?、?、洗涤、干燥。
(4)碳酸化Ⅰ中发生主要反应的离子方程式是__________________________。
(5)碳酸化Ⅱ调整pH=8的目的是_______________________________。
本题答案:(1)2Al(OH)3 Al2O3+ 3H2O (3分)
Al2O3+ 3H2O (3分)
(2)CO2或二氧化碳(2分)? Na+、K+、HCO3?(3分,各1分,错写、多写每个倒扣1分至0分)
(3)蒸发浓缩、冷却结晶、过滤(3分,各1分)
(4)2AlO2? + CO2 + 3H2O =2Al(OH)3↓+ CO32?(3分,产物写成HCO3—给0分)
(5)碳酸根转化为碳酸氢根离子(1分),利于KHCO3结晶析出(1分)
本题解析:(1)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体。溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO2后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)3 Al2O3+ 3H2O。
Al2O3+ 3H2O。
(2)物质X是二氧化碳,滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-。
(3)碳酸化Ⅰ的目的是制备氢氧化铝,又因为溶液的pH=11,所以生成的是碳酸盐,而不是碳酸氢盐,即该反应的离子方程式应该是2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即可。
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2? + CO2 + 3H2O =2Al(OH)3↓+ CO32?。
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾, 所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出。
本题所属考点:【物质的分离、提纯】
本题难易程度:【困难】
Economy is itself a great income. 节约本身就是一大笔收入.