微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
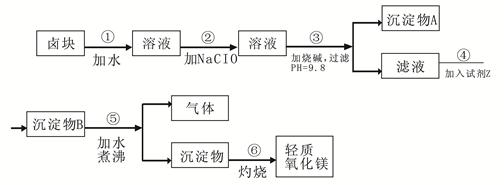
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:?
表1?生成氢氧化物沉淀的pH
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Fe(OH)2
| 7.6
| 9.6
|
Mn(OH)2
| 8.3
| 9.8
|
Mg(O H)2
| 9.6
| 11.1
|
?
表2?化学试剂价格表
试剂
| 价格(元/吨)
|
漂液(含NaClO,25.2%)
| 450
|
双氧水(含H2O2 ,30%)
| 2400
|
烧碱(含98% NaOH)
| 2100
|
纯碱(含99.5% Na2CO3)
| 600
|
?
(1)在步骤②中加入漂液而不是双氧水其原因是?。
写出加入NaClO发生反应的离子方程式?。
(2)在步骤③中控制pH=9.8,其目的是?。
(3)沉淀物A的成分为?,试剂Z应该是?。
(4)在步骤⑤中发生反应的化学方程式是?。
(5)若在实验室中完成步骤⑥,则沉淀物必需在?(填仪器名称)中灼烧。
填空题 卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:

已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:?
表1?生成氢氧化物沉淀的pH
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)3
| 2.7
| 3.7
|
Fe(OH)2
| 7.6
| 9.6
|
Mn(OH)2
| 8.3
| 9.8
|
Mg(OH)2
| 9.6
| 11.1
|
?
表2?化学试剂价格表
试剂
| 价格(元/吨)
|
漂液(含NaClO,25.2%)
| 450
|
双氧水(含H2O2 ,30%)
| 2400
|
烧碱(含98% NaOH)
| 2100
|
纯碱(含99.5% Na2CO3)
| 600
|
?
(1)在步骤②中加入漂液而不是双氧水其原因是?。
写出加入NaClO发生反应的离子方程式?。
(2)在步骤③中控制pH=9.8,其目的是?。
(3)沉淀物A的成分为?,试剂Z应该是?。
(4)在步骤⑤中发生反应的化学方程式是?。
(5)若在实验室中完成步骤⑥,则沉淀物必需在?(填仪器名称)中灼烧。
本题答案:(1)漂液比H2O2的价格低得多。(2分)?2Fe2++ClO-+2H+=2Fe3++Cl-+H2O(3分)
(2)使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。(2分)
(3)Fe(OH)3 、 Mn(OH)2、 Mg(OH)2?(2分,写3个且全对得2分,只写其中2个且写对得1分,其他情况都得0分)?纯碱?(2分)
(4)MgCO3 +H 2O?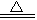 ?Mg(OH)2↓+ CO2↑?(3分, 产物写成碱式碳酸镁也算正确)
?Mg(OH)2↓+ CO2↑?(3分, 产物写成碱式碳酸镁也算正确)
(5)坩埚?(2分)
本题解析:(1)表2为一个试剂价格表,在漂白液和双氧水均可做氧化剂时,从经济角度应该选漂液更加实惠;因此加入漂白液次氯酸钠后发生的化学反应的离子方程式为
2Fe2+ ?+?ClO-+?2H+?= ?2Fe3+ ?+?Cl-+?H2O。
(2)从表1的离子沉淀PH值可以看出步骤③调节pH值目的是使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便过滤除去。
(3)步骤③调节pH值使除Mg2+以外的各种杂质金属离子都沉淀了,但pH值已略微超过了Mg2+ 开始沉淀的pH值,所以得到的沉淀物A为Fe(OH)3 、 Mn(OH)2,也有 Mg(OH)2 ;沉淀物B在水中加热煮沸可以生成气体,同时又生成沉淀物Mg(OH)2 ,则沉淀物B一定不是Mg(OH)2 ,所以加入的Z物质在表2中只能选纯碱。
(4)加入的Z物质为纯碱,所以生成的沉淀物B是MgCO3,所以沉淀物MgCO3在煮沸的情况下发生水解,生成Mg(OH)2 和CO2气体。化学方程式为MgCO3 +H 2O? ?Mg(OH)2↓+ CO2↑ 。
?Mg(OH)2↓+ CO2↑ 。
(5)氢氧化镁灼烧制备氧化镁,应该在耐高温的容器坩埚中进行。
本题所属考点:【物质的分离、提纯】
本题难易程度:【困难】
I cannot afford to waste my time making money. 我浪费不起时间去赚钱.