微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下 91ExaM.org:
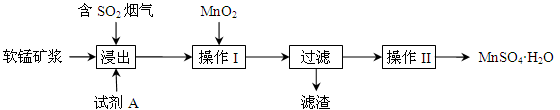
已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式:?。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将?(“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是?。
a.MnCO3? b.MnO2? c.CaO? d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还?,使Fe3+沉淀。检验过滤后溶液中是否含有Fe3+的操作是?。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为:?、?、洗涤、干燥。工业上为了充分利用锰元素,在流程中?可循环使用。
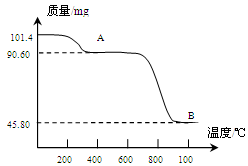
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为?;MnxO4中x=??。
填空题 为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下:

已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式:?。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将?(“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是?。
a.MnCO3? b.MnO2? c.CaO? d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还?,使Fe3+沉淀。检验过 91eXaM.org滤后溶液中是否含有Fe3+的操作是?。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为:?、?、洗涤、干燥。工业上为了充分利用锰元素,在流程中?可循环使用。
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为?;MnxO4中x=??。

本题答案:(1)MnO2 + SO2→ MnSO4 (或SO2+ H2O → H2SO3? MnO2 + H2SO3→ MnSO4+ H2O)(2分)
(2)不利(1分);? a(1分)
(3)调节溶液pH,促进Fe3+水解生成Fe(OH)3(1分)
取上层清液,滴加KSCN,若溶液不显血红色,则说明Fe3+已沉淀完全(1分)
(4)蒸发浓缩、趁热过滤(2分)?操作II后剩余的母液(1分)
(5)MnSO4(1分)? 3(2分)
本题解析:(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,反应的化学方程式为MnO2 + SO2→ MnSO4。
(2)溶液的pH下降,溶液的酸性增强,则不利于吸收SO2。欲消除生成的硫酸,同时还不能引入新的杂质,则试剂A最好是碳酸锰,二氧化锰与硫酸不反应,cd会引入钙离子,答案选a。
(3)由于在沉淀铁离子的同时而不能减少锰离子,所以根据沉淀时的pH值可知,MnO2在氧化Fe2+的?同时还调节溶液pH,促进Fe3+水解生成Fe(OH)3。铁离子能与KSCN溶液发生显色反应,所以检验过滤后溶液中是否含有Fe3+的操作是取上层清液,滴加KSCN,若溶液不显血红色,则说明Fe3+已沉淀完全。
(4)由于大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,因此操作II的过程为蒸发浓缩、趁热过滤;由于操作II后剩余的母液中还含有锰离子,所以工业上为了充分利用锰元素,在流程中操作II后剩余的母液可循环使用。
(5)A曲线时固体减少的质量为101.4mg-90.60mg=10.8mg,为原固体中结晶水的质量为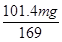 ×18=10.8mg,所以A曲线对应的物质化学式为MnSO4。MnxO4的质量是45.80mg,则根据锰元素守恒可知
×18=10.8mg,所以A曲线对应的物质化学式为MnSO4。MnxO4的质量是45.80mg,则根据锰元素守恒可知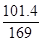 =
= ×x,解得x=3。
×x,解得x=3。
本题所属考点:【物质的分离、提纯】
本题难易程度:【一般】
A wise man cares not for what he cannot have. 智者不为自己得不到的东西而烦恼.