微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是?。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是?。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是?。
(4)实验时需强力搅拌45min,其目的是?;结束后需调节溶液的pH 7~8,其目的是?。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水。
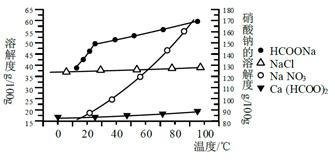
请补充完整由碳酸钙制备甲酸钙的实验步骤
金属
离子
| 开始沉淀
的pH
| 沉淀完全
的pH
|
Fe3+
| 1. 1
| 3. 2
|
Al3+
| 3. 0
| 5. 0
|
Fe2+
| 5. 8
| 8. 8
|
?
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2.?。
步骤3.?。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、??、洗涤、60℃时干燥得甲酸钙晶体。
填空题 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是?。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是?。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是?。
(4)实验时需强力搅拌45min,其目的是?;结束后需调节溶液的pH 7~8,其目的是?。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水。

请补充完整由碳酸钙制备甲酸钙的实验步骤
金属
离子
| 开始沉淀
的pH
| 沉淀完全
的pH
|
Fe3+
| 1. 1
| 3. 2
|
Al3+
| 3. 0
| 5. 0
|
Fe2+
| 5. 8
| 8. 8
|
?
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2.?。
步骤3.?。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、??、洗涤、60℃时干燥得甲酸钙晶体。
本题答案:
Ⅰ(1)使甲醛充分氧化,提高甲醛的利用率和产品纯度(2分)
(2)防止H2O 2分解和甲醛挥发(2分)
(3)除去重金属离子(使重金属离子形成硫化物沉淀除去)(2分)
(4)使反应物充分接触,提高产率(2分);防止甲酸钙水解(或除去甲酸)(2分)
Ⅱ 用稍过量硝酸溶解碳酸钙样品(2分);用石灰水调整溶液pH 5(2分);趁热过滤(1分)。
或:用稍过量盐酸溶解碳酸钙样品(2分);滴入适量的H2O2,并用石灰水调节溶液pH为 5(2分);过滤(1分)。
本题解析:Ⅰ(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率;(2)双氧水易分解,甲醛易挥发,所以温度不易过高;(3)题干中提出产品中重金属含量极低,故该步是产生难溶的硫化物,除去重金属离子;(4)搅拌是使使反应物充分接触,使其反应完全,提高产率;甲酸钙为碱性水解,溶液为弱碱性是抑制其水解;Ⅱ该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出。
本题所属考点:【物质的分离、提纯】
本题难易程度:【困难】
I had rather do and not promise, than promise and not do. 宁愿多做事少许诺,不愿多许诺而不做事.