微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (17分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂,在食品、牙粉、化妆品等制造中用作添加剂。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
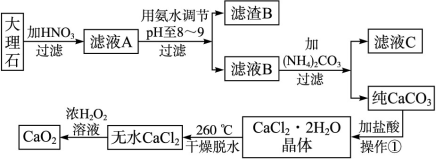
请回答下列问题:
(1)操作①中应包括?、?、?用氨水调节pH至8~9的目的是______________。
(2)若测得滤液C中c(CO )=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
)=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH )?c(NO
)?c(NO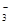 ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为?。
) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为?。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:_______________,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9 91Exam.org~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因_________________________。
(5)写出CaO2与H2O反应的化学方程式?。
填空题 (17分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂,在食品、牙粉、化妆品等制造中用作添加剂。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①中应包括?、?、?用氨水调节pH至8~9的目的是______________。
(2)若测得滤液C中c(CO )=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
)=2.50×10-4 mol·L-1,则Ca2+_?_____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH )?c(NO
)?c(NO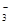 ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为?。
) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为?。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:_______________,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因_________________________。
(5)写出CaO2与H2O反应的化学方程式?。
本题答案:(1)溶解、过滤、蒸发结晶(3分);除去Fe3+或使Fe3+转化为Fe(OH)3沉淀被除去(2分)
(2)否(2分)
(3)<(2分)? c(NH4+)>c(CO32?)>c(OH?)>c(H+) (2分)
(4)CaCl2+H2O2 CaO2+2HCl(2分) 加入NaOH溶液使上述平衡向正反应方向移动,有利于CaO2沉淀的生成(2分)
CaO2+2HCl(2分) 加入NaOH溶液使上述平衡向正反应方向移动,有利于CaO2沉淀的生成(2分)
(5)2CaO2+2H2O=2Ca(OH)2+O2↑(2分)
本题解析:(1)沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体;因大理石中的主要杂质是氧化铁,它与硝酸反应生成了Fe(NO3)3,在调节pH到8~9时,Fe3+会以Fe(OH)3沉淀形式进入滤渣,从而除去了杂质离子Fe3+。
(2)根据离子积Ksp(CaCO3)=4.96×10-9 =c(Ca2+)·c(CO ),得c(Ca2+)=4.96×10-9/2.50×10-4 mol·L-1=1.98×10-5 mol·L-1 > 10-5 mol·L-1,没有沉淀完全。
),得c(Ca2+)=4.96×10-9/2.50×10-4 mol·L-1=1.98×10-5 mol·L-1 > 10-5 mol·L-1,没有沉淀完全。
(3)由电荷守恒:c(H+)+c(NH )=c(OH-)+c(NO
)=c(OH-)+c(NO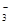 ),因c(H+)>c(OH-),故c(NH
),因c(H+)>c(OH-),故c(NH )<c(NO
)<c(NO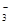 )。
)。
(4)由CaCl2+H2O2 CaO2+2HCl,加入NaOH溶液,NaOH与HCl发生中和反应,减少了生成物浓度,使上述平衡向正反应方向移动,有利于CaO2沉淀的生成。
CaO2+2HCl,加入NaOH溶液,NaOH与HCl发生中和反应,减少了生成物浓度,使上述平衡向正反应方向移动,有利于CaO2沉淀的生成。
(5)CaO2中O元素的化合价为—1价,部分化合价升高转化为O2,部分化合价降低转化为Ca(OH)2,所以化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑
本题所属考点:【物质的分离、提纯】
本题难易程度:【困难】
He is born in a good hour who gets a good name. 生逢其时,美誉自至.