微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式正确的是(?)
A.硫酸钠稀溶液与三氧化硫反应:SO4 2-+SO3+H2O=2H++2SO42-
2-+SO3+H2O=2H++2SO42-
B.硫酸铝溶液和小苏打溶液混合:Al3++2HCO3-=3CO2+Al(OH)3
C.氯气和溴化钠反应:Cl2+2Br -=2Cl-+Br2
-=2Cl-+Br2
D.碳酸钡溶于醋酸:BaCO3+2CH3COOH=Ba2++2CH3COO-+ H2O+CO2
H2O+CO2
参考答案:C
本题解析:略
本题难度:一般
2、简答题 下列离子方程式书写正确的是( )
A.铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
B.盐酸与饱和的澄清石灰水反应:H++OH-═H2O
C.碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O
D.稀硫酸与锌反应:H2SO4+Zn═Zn2++SO42-+H2↑
参考答案:A.铁跟稀硫酸反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.盐酸与饱和的澄清石灰水反应的离子反应为H++OH-═H2O,故B正确;
C.碳酸钙与醋酸反应的离子反应为CaCO3+2HAc═Ca2++CO2↑+H2O+2Ac-,故C错误;
D.锌跟稀硫酸反应的离子反应为Zn+2H+═Zn2++H2↑,故D错误;
故选B.
本题解析:
本题难度:一般
3、选择题 下列反应离子方程式正确的是( )
A.苯酚与氢氧化钠溶液反应C6H5OH来源:91exam .org+OH--C6H5O-+H2O
B.碳酸钙溶于醋酸CaCO3+2H+=Ca2++CO2↑+H2O
C.碳酸钠溶液加入过量的苯酚2C6H5OH+CO32--2C6H5O-+CO2↑+H2O
D.过量银氨溶液:HCHO+2[Ag(NH3)2]++2OH--HCOO-+NH4++2Ag↓+3NH3+H2O
参考答案:A.苯酚与氢氧化钠溶液反应的离子反应为C6H5OH+OH-→C6H5O-+H2O,故A正确;
B.碳酸钙溶于醋酸的离子反应为CaCO3+2HAc=Ca2++2Ac-+CO2↑+H2O,故B错误;
C.碳酸钠溶液加入过量的苯酚的离子反应为C6H5OH+CO32-→C6H5O-+HCO3-,故C错误;
D.甲醛与过量银氨溶液反应的离子反应为HCHO+4[Ag(NH3)2]++4OH-→CO32-+2NH4++4Ag↓+6NH3+2H2O,故D错误;
故选A.
本题解析:
本题难度:一般
4、简答题 现有100mLAlCl3与MgSO4的混合溶液,分成两等份.
(1)向其中一份中加入10mL4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是______.继续加入lmol/LNaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是______,剩余的沉淀的物质的量是______.
(2)向另一份中加入amL0.1mol/LBaCl2溶液能使SO42-沉淀完全,a=______.
参考答案:(1)向其中一份中加入10mL 4mol/L的氨水,恰好完全反应反应为A13++3NH3?H2O=Al(OH)3↓+3NH4+;Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+;继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是Al(OH)3+OH-=[Al(OH)4]-,计算得到氢氧化铝物质的量为0.01mol,消耗一水合氨物质的量0.03mol,所以沉淀镁离子的一水合氨物质的量为0.01mol,镁离子物质的量为0.005mol,生成氢氧化镁沉淀物质的量为0.005mol;
故答案为:A13++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-=[Al(OH)4]-;0.005mol;
(2)依据(1)计算得到镁离子物质的量为0.005mol,原混合溶液中含有硫酸根离子物质的量为0.005mol,依据Ba2++SO42-=BaSO4↓计算得到a1000L×0.1mol/L=0.005mol,a=50;
故答案为:50.
本题解析:
本题难度:一般
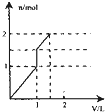
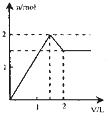
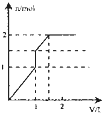
5、选择题 向含1mol?HCl和l?mol?MgSO4的混合溶液中加入1mol/L的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
A.
B.
C.
D.
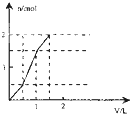
参考答案:含1mol?HCl和l?mol?MgSO4的混合溶液中加入Ba(OH)2后,首先发生反应Ba2++SO42-=BaSO4↓,生成既不溶于水又不溶于酸的BaSO4沉淀,同时OH-跟盐酸的H+发生中和反应OH-+H+=H2O,由于HCl的存在,OH-不能与Mg2+产生沉淀Mg(OH)2,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀,由OH-+H+=H2O可知,H+完全反应时加入的Ba(OH)2为0.5mol,加入Ba(OH)2溶液的体积为0.5mol1mol/L=0.5L=500mL,产生参加反应的硫酸根为0.5mol,此阶段沉淀n(BaSO4)=0.5mol,溶液中n(SO42-)=1mol-0.5mol=0.5mol,n(Mg2+)=1mol;
继续加入Ba(OH)2,发生反应Ba2++SO42-=BaSO4↓、Mg2++2OH-=Mg(OH)2↓,此时加入相同质体积的Ba(OH)2溶液,生成的沉淀的量比上一阶段要多,当再加入0.5molBa(OH)2时,溶液中的SO42-恰好沉淀,参加反应的Mg2+物质的量为0.5mol,此阶段又产生沉淀n(BaSO4)=0.5mol,n[Mg(OH)2]=0.5mol,加入Ba(OH)2溶液的体积为0.5mol1mol/L=0.5L=500mL,此时溶液中n(Mg2+)=1mol-0.5mol=0.5mol;
在继续加入Ba(OH)2溶液,发生反应Mg2++2OH-+=Mg(OH)2↓,沉淀的量继续增大,此时加入相同质体积的Ba(OH)2溶液,生成的沉淀的量较第二阶段小,但与第一阶段相同,但当再加入0.5molBa(OH)2时,0.5molMg2+完全沉淀,加入Ba(OH)2溶液的体积为0.5mol1mol/L=0.5L=500mL,此时沉淀达最大量,此阶段又产生沉淀n[Mg(OH)2]=0.5mol,再加入Ba(OH)2溶液不再产生沉淀.
由上述分析可知三个阶段加入的加入Ba(OH)2溶液的体积相同为500mL;
第一阶段产生沉淀n(BaSO4)=0.5mol;
第二阶段又生成沉淀n(BaSO4)=0.5mol,n[Mg(OH)2]=0.5mol,此时沉淀总量为1.5mol,加入Ba(OH)2溶液的总体积为1L;
第三阶段又生成沉淀n[Mg(OH)2]=0.5mol,此时沉淀总量为2mol,加入Ba(OH)2溶液的总体积为1.5L.
沉淀的量与Ba(OH)2溶液体积关系图为:
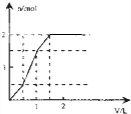
.
故选:D.
本题解析:
本题难度:一般