微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法,正确的是( )
A.电解质溶于水一定放出热量
B.可逆反应在加热时正逆反应速率都增大
C.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
D.25℃时,0.01mol/L的氢氧化钠溶液中,水电离的c(H+)与水电离的c(OH-)的积为10-14
参考答案:A、有的电解质如硝酸铵溶于水是吸热过程,有的是放热过程,故A错误;
B、对于可逆反应,加热时正逆反应速率都增大,故B正确;
C、溶液导电能力和自由移动离子的浓度大小有关,和电解质的强弱无关,故C错误;
D、25℃时,0.01mol/L的氢氧化钠溶液中,根据Kw计算,水电离出的氢离子和氢氧根浓度相等均为10-12mol/L,所以水电离的c(H+)与水电离的c(OH-)的积为10-24,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是?
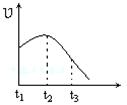
A.从t1→t2的主要原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的主要原因是镁与水反应,致使酸的浓度升高
C.从t2→t3的主要原因是随着反应的进行镁体积减少
D.从t2→t3的主要原因是随着反应的进行温度越来越低
参考答案:A
本题解析:应用镁和盐酸的反应是放热反应,随着温度的升高,反应速率逐渐增大,A正确。但随着反应的进行,氢离子的浓度逐渐减小,所以反应速率又逐渐降低下来,因此BCD都是错误的,答案选A。
本题难度:一般
3、选择题 在一固定体积的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g) xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
xC(g),平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
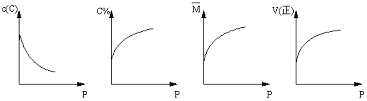
A B C D
参考答案:D
本题解析:两种状态是等效平衡,该恒容恒温下有两种情况,一种是x=3,一种是x=2的全等平衡,前一种压强不影响平衡,后一种压强增大平衡正向移动。A、压强增大,两种情况C浓度增大,错误;B、第一种体积分数不变,后一种变大,错误;C、第一种不变,错误;D、增大压强,正逆反应速率均增大,正确。
考点:考查平衡移动、反应速率等有关问题。
本题难度:困难
4、选择题 在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) 3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
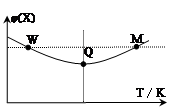
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
参考答案:C
本题解析:A、分析图像,X的体积分数先减小后增大,减小到最低,这是化学平衡的建立过程,后增大,这是平衡的移动过程,升高温度,体积分数增大,说明升高温度,平衡向左移动,使平衡常数减小,故A错误; B、M点温度高,故反应速率快,B错误;从开始到Q点是正向建立平衡的过程,转化率逐渐增大,从Q到M点升高温度,平衡向左移动,使转化率降低,Q点最大,故C正确;平衡时再充入Z,达到的新平衡与原平衡是等效平衡,体积分数相等,故D错误;故选C。
本题难度:一般
5、选择题 在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生:
①IO3-+5I-+ 6H+==3I2+3H2O;
②I2+2HSO3-+H2O==2I-+2SO42-+4H+。
当反应进行到15min时,溶液突然变为蓝色,随之又很快消失。这一反应被称做时钟反应,有人用它来解释生物钟现象。下列有关说法不正确的是
[? ]
A.在整个反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关
参考答案:C
本题解析:
本题难度:一般