微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列烧杯中盛放的都是稀硫酸,在铜棒上不能产生气泡的是( ?)
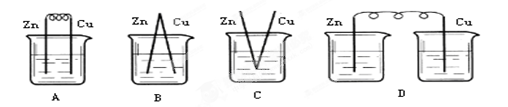
参考答案:D
本题解析:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应。原电池中正极上发生还原反应,负极上发生氧化反应。A、B、C三个装置中均构成构成原电池,铜作正极,正极上氢离子得电子生成氢气;D、该装置没有形成闭合回路,所以铜极上没有气泡产生,所以正确的答案选D。
点评:该题是高考中的常见考点,属于基础性试题的考查,难度不大。明确原电池的工作原理、构成条件是答题的关键。
本题难度:简单
2、选择题 下列各种变化属于原电池反应的是( )
A.红热的铁丝与冷水接触,表面形成蓝黑色保护层
B.镀锌铁皮有划痕,仍然能阻止铁被氧化
C.在空气中铝表面迅速氧化形成保护层
D.锌与稀硫酸反应时,加入醋酸钠溶液反应减慢
参考答案:A.红热的铁丝与冷水接触,发生Fe与水发生化学反应,与电化学无关,故A不选;
B.Zn比Fe活泼,构成原电池,Fe作正极,所以Fe被保护,与电化学有关,故B选;
C.在空气中铝表面迅速氧化形成保护层是因Al被氧化为氧化铝,与电化学无关,故C不选;
D.锌与稀硫酸反应时,加入醋酸钠溶液反应减慢,发生金属与酸的置换反应,醋酸为弱酸,与电化学无关,故D不选;
故选B.
本题解析:
本题难度:简单
3、选择题 某原电池构造如图所示。下列有关叙述正确的是

[? ]
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.1 mol电子,铜的质量理论上减小6.4g
D.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
参考答案:D
本题解析:
本题难度:一般
4、选择题 下面能够构成原电池及电极反应式正确的是
A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e-==Fe2+
B.Al、Cu、稀硫酸,负极反应式为:Cu-2e-==Cu2+
C.Al、Mg、NaOH溶液,负极反应式为:Al+4OH--3e-==AlO2-+2H2O
D.Zn、Cu、乙醇,负极反应式为:Zn-2e-==Zn2+
参考答案:C
本题解析:A错,负极为Cu,因为Fe在浓硝酸溶液中会发生钝化,所以负极反应式为:Cu-2e-==Cu2+;B错,负极Al,反应式为AL-3e-==AL3+;C正确,Al与NaOH溶液能反应,Mg与NaOH溶液不反应,所以负极反应式为:Al+4OH--3e-==AlO2-+2H2O;D错,乙醇为非电解质,不能构成原电池;
本题难度:一般
5、填空题 今有反应2H2+O2=2H2O,构成燃料电池,负极通的气体应是______.
①若电解质溶液为KOH溶液,则电极反应式为:负极______,正极______.
②若电解质溶液改为稀硫酸溶液,则电极反应式为:负极______,正极______.
参考答案:根据反应式可知H2在反应中被氧化,O2被还原,H2应在负极发生反应,O2在正极反应,故答案为:H2;
①燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,则正极:O2+2H2O+4e-=4OH-;负极的电极方程式为2H2+4OH-=4H2O+4e-,
故答案为:2H2+4OH-=4H2O+4e-;O2+2H2O+4e-=4OH-;
②如把KOH改为用稀H2SO4作电解质溶液,则正极:O2+4H++4e-=2H2O;负极的电极方程式为:2H2=4H++4e-.
故答案为:2H2=4H++4e-;O2+4H++4e-=2H2O.
本题解析:
本题难度:简单