微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学实验设计和操作中必须十分重视安全问题和环保问题。下列实验问题处理方法不正确的是
[? ]
①在制取氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②在气体发生装置上直接点燃CO时,必须先检验CO的纯度,最简单的方法是用排空气法收集一试管气体,点燃气体,听爆鸣声。
③分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
④用pH试纸测定溶液的pH时,应用干燥洁净的玻璃棒蘸取溶液,点在pH试纸的中部,待变色后再跟标准比色卡比较
⑤酒精着火时可用湿抹布或沙子扑火
⑥用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
A.①⑥
B.②③
C.②④
D.③④
参考答案:B
本题解析:
本题难度:一般
2、实验题 欲除去硝酸钾固体中混有的少量氯化钾杂质,某学生进行如下实验操作。回答下列问题:
(1)溶解样品。该过程所需的仪器有_______________。
(2)向溶解后的溶液中加入适量的_________溶液,使氯化钾转化为__________沉淀。(填化学式)
(3)将混合液进行过滤,过滤装置和操作如图所示,指出图中的两处错误:
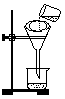
①_______________________;②______________________。
参考答案:(1)烧杯、玻璃棒
(2)AgNO3;AgCl
(3)①漏斗下端管口没有紧靠烧杯内壁;②液体没有用玻璃棒引流
本题解析:
本题难度:一般
3、实验题 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成填空:
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→?→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量?g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、?、?。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验编号
| NaOH溶液的浓度(mol/L)
| 滴定完成时, NaOH溶液滴入的体积(mL)
| 待测盐酸溶液的体积(mL)
|
1
| 0.10
| 22.62
| 20.00
|
2
| 0.10
| 22.72
| 20.00
|
3
| 0.10
| 22.80
| 20.00
|
?
①滴定达到终点的标志是?。
②根据上述数据,可计算出该盐酸的浓度约??(保留两位有效数字)。
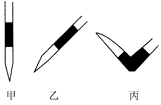
③排去碱式滴定管中气泡的方法应采用如图所示操作中的?(选择甲、乙、丙之一),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:?。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外。
E.碱式滴定管尖嘴部分有气泡,滴定后消失
参考答案:(1)①定容?②0.4?烧杯(或表面皿)药匙
(2)①最后一滴NaOH溶液加入,溶液由无色恰好变成粉红色?②0.11 mol/L?③丙 ④? DE
本题解析:试题分析:(1)①配制一定体积一定物质的量浓度的溶液的操作步骤是计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→ 摇匀→ 装瓶 →贴签。②n(NaOH)=" 0.100" L ×0.10 mol/L=0.01mol.m(NaOH)=0.01mol×40g/mol=0.4g.因此要称量0.4gNaOH. 所需仪器有:天平(带砝码、镊子)烧杯、药匙。(2)①由于是用已知浓度的碱滴定未知浓度的酸,所以指示剂在酸溶液中,当滴定达到终点时会看到溶液由无色变为红色,且半分钟内不褪色即可确定滴定达到了终点。②V(NaOH)= (22.62+22.72+22.80)ml÷3=22.71ml.因为HCl恰好反应时物质的量的比为1:1.所以c(HCl)=" (" 0.10 mol/L×22.71ml)÷20.00ml=" 0.11" mol/L. ③ 排去碱式滴定管中气泡的方法应采用如图所示操作中的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。④A.滴定终点读数时俯视读数,读数偏小,则溶液的体积就偏小。计算出待测溶液的浓度就偏低。错误。B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗。则待测盐酸溶液的物质的量就偏少,滴定时消耗的标准溶液的体积偏小,计算出待测溶液的浓度就偏低。错误。C.锥形瓶水洗后未干燥。不会影响实验测定结果。错误。D.滴定过程中,有少量标准液溅出锥形瓶外。为了将待测溶液进行滴定,就要多滴加标准溶液,标准溶液体积偏大,由此计算出待测溶液的浓度就偏高。正确。E.碱式滴定管尖嘴部分有气泡,滴定后消失。开始读数偏小,后来读数偏小,则消耗的标准溶液的体积就偏多,由此计算出待测溶液的浓度就偏高。正确。
本题难度:一般
4、实验题 (13分)某含少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验步骤如下:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3 mL溴水,加热使Fe2+完全被氧化;
mL溴水,加热使Fe2+完全被氧化;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操 作至恒重。
作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量?。
A.比m g多? B.比m g少? C.恰好为m g
(2)溶解样品时要加入盐酸,原因是?。
(3)配250mL溶液时,除需250mL容量瓶、烧杯外,还需用到的玻璃仪器是?、?。
(4)加入溴水时发生反应的离子方程式是?。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是?。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量:①NaCl?;②Fe2(SO4)3?(填“偏高”、“偏低”或“不变”)。
参考答案:(1)B (1分);
(2)抑制Fe2+、Fe3+的水解(2分);
(3)玻璃棒(1分)、胶头滴管(1分);
(4)2Fe2++Br2=2Fe3++2Br-(2分);
(5)7(W2-W1)/m(2分);
(6)①不变(2分)、 ②偏高(2分)。
②偏高(2分)。
本题解析:略
本题难度:简单
5、选择题 实验操作的规范是实验的基本要求。下列实验操作正确的是
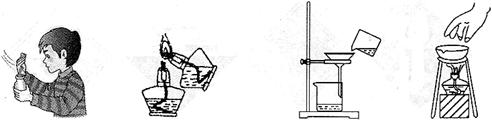
A? B? C? D
参考答案:A
本题解析:A、正确;B、酒精灯不能相互点燃,错误;C、应用玻璃棒引流,错误;D、应用坩埚钳夹取蒸发皿,错误。
本题难度:一般