微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列与实验相关的叙述正确的是
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
D.使用pH试纸测某溶液的pH时,应先将试纸润湿再测定
参考答案:C
本题解析:
分析:稀释硫酸的操作是“酸入水”,防止酸液飞溅;配制溶液时,如果加水超过容量瓶刻度,会导致溶液的浓度偏低,即使用胶头滴管吸出多余的水也不能改变溶液的浓度,正确的做法是重新配制;酸碱中和滴定时滴定管可用标准液或待测液润洗,否则会导致溶液浓度偏低,但锥形瓶不能用待测液润洗,会导致测定结果偏高;检验SO42-时,不能加入BaCl2溶液和稀盐酸,不能排除AgCl的干扰,应加入硝酸酸化的硝酸钡溶液.
解答:稀释硫酸的操作是将浓硫酸玻璃棒缓慢注入水中,否则会导致酸液飞溅,故A错;若将多余的水取出,会使得浓度偏小,加水超过容量瓶的刻度的唯一办法是重新配制,故B错;用待测液润洗锥形瓶,则消耗的标准液会偏多,导致结果偏高,故C正确;操作中,若溶液中含有Ag+,也会有不溶解于盐酸的白色沉淀产生,则溶液中不一定含有SO42-,故D错;故选:C.
点评:本题涉及到溶液的稀释、溶液的配制、酸碱中和滴定等实验基本操作以及离子的检验,难度不是很大,要注重基本实验操作的正确方法和相关注意事项;离子检验时要注意排除其它离子的干扰.
本题难度:一般
2、选择题 下列有关化学实验叙述正确的是
A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水
B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶
C.存放浓硝酸时,使用带橡胶塞的棕色玻璃瓶
D.取用化学药品做实验,剩余药品都倒入同一废液缸中
参考答案:A
本题解析:A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水,正确;B.由于配制的是质量分数浓度的溶液,除使用量筒外还需烧杯就行,错误;C.浓硝酸能腐蚀橡胶塞,错误;D.取用化学药品做实验,如果是固体剩余药品要回收,错误;
本题难度:一般
3、实验题 A装置中装有淡黄色的固体,分液漏斗中装有浓盐酸,B中盛浓硫酸,C中放有催化剂,D中盛淀粉碘化钾溶液,E中盛足量的NaOH溶液,F中盛FeSO4和H2SO4混合溶液。?
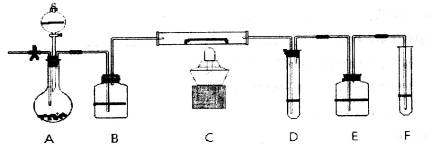
先打开止水夹,通入N2,待装置中空气被赶尽后关诩止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置乖O3)。
(1)淡黄色固体所含化学键的名称为:________;装有遮黄色的固体仪器的名称_______。
(2)如何检查装置的气密性___________________________________________________。
(3)C中反应的化学方程式___________________________________________________。
(4)E装置中反应的离子方程式_______________________________________________。
(5)如F中仍有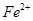 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。
参考答案:
(1)离子键、共价键(2分)?圆底烧瓶(1分)
(2)关闭止水夹,将F中的导管深入水槽中,用酒精灯给圆底烧瓶微热,导管口有气泡产生,冷却后,导管出现水柱。(3分)
(3)4HCl + O2 ?2Cl2 + 2H2O (2分)
?2Cl2 + 2H2O (2分)
(4)Cl2 +2OH? = Cl? + ClO? + H2O (2分)
(5)取F中少量溶液于小试管中,滴加一滴KMnO4溶液,KMnO4溶液褪色,说明含有Fe2+(2分)
本题解析:(1)淡黄色固体为Na2O2,含有离子键和共价键。
(2)利用加热气体膨胀的原理进行检验,首先要答上:关闭止水夹,将F中的导管深入水槽中。
(3)C中进入的气体含有HCl、O2,在催化剂存在的条件下加热发生氧化还原反应。
(4)E中发生Cl2与NaOH的反应 。
(5)利用Fe2+具有还原性,能使KMnO4褪色的现象检验。
本题难度:一般
4、选择题 下列实验操作正确的是
[? ]
A.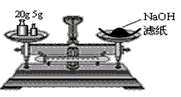
? 称量氢氧化钠固体
B.
? 分离柴油和水
C.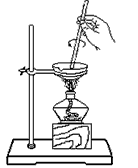
? 把饱和食盐水中的食盐提取出来
D.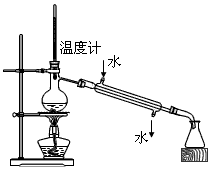
? 分离两种互溶但沸点相差较大的液体混合物
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列说法中不正确的是?
①用稀盐酸清洗做焰色反应的金属铂丝
②医疗上可用碳酸钡作X射线透视肠胃的内服药
③水玻璃在建筑业用做粘合剂
④铝和铜具有良好的导电性,所以电工操作时,可把铜线和铝线绞接在一起
⑤氯化铵可用于金属的焊接上,以除去金属表面的氧化物薄膜
⑥医用酒精的质量分数为75%
⑦用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖
A.②③⑦
B.④⑤⑥
C.①③⑤
D.②④⑥
参考答案:D
本题解析:由于碳酸钡与胃酸能反应生成可溶性的钡盐导致人体中毒,实际使用的是硫酸钡;不同活泼程度的金属铰接在一起,有可能形成原电池而加速金属的腐蚀;酒精一般采用体积分数来表示,而不是质量分数。
本题难度:一般