微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数K随温度的变化如
H2(g) + CO2(g)的平衡常数K随温度的变化如
下表 ,下列说法正确的是
温度/℃
| 400
| 500
| 830
| 1000
|
平衡常数K
| 10
| 9
| 1
| 0.6
|
A.正反应是吸热反应
B.830℃时,反应达到平衡,[CO]=[CO2]
C.恒温时缩小容器体积使压强增大,正反应速率增大
D.400℃时,恒容反应器中投入CO、H2O、H2、CO2物质的量分别为5 mol、1 mol、2 mol、3mol,反应向逆方向进行
2、选择题 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压强/kPa
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度/10-3mol/L
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
|
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
3、填空题 高炉炼铁中发生的基本反应之一如下:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,其平衡常数表达式为K= ,又知1 100 ℃时,K=0.28。
Fe(s)+CO2(g) ΔH>0,其平衡常数表达式为K= ,又知1 100 ℃时,K=0.28。
(1)温度升高,化学平衡移动后达到新的平衡,平衡常数 。(填“变大”“变小”或“不变”)
(2)1 100 ℃时测得高炉中c(CO2)=0.013 mol·L-1,c(CO)=0.05 mol·L-1,在这种情况下,该反应是否处于化学平衡状态: (填“是”或“否”),此时,化学反应速率是v(正) v(逆)(填“大于”“小于”或“等于”),其原因 。
4、填空题 (10分)已知Fe(s)+CO2(g) FeO(s)+CO(g) K1…①
FeO(s)+CO(g) K1…①
Fe(s)+H2O(g) FeO(s)+H2(g) K2…②
FeO(s)+H2(g) K2…②
H2(g)+CO2(g) H2O(g)+CO(g) K3…③
H2O(g)+CO(g) K3…③
又已知不同温度下,K1、K2值如下:
温度℃
| K1
| K2
|
500
| 1.00
| 3.15
|
700
| 1.47
| 2.26
|
900
| 2.50
| 2.00
|
温度℃
| K1
| K2
|
500
| 1.00
| 3.15
|
700
| 1.47
| 2.26
|
900
| 2.50
| 2.00
|

(1)若500℃时进行反应①,CO2起始浓度为1.6 mol·L-1, 4分钟后建立平衡,用CO表示的反应速率为 。
(2)900℃ 进行反应③,其平衡常数K3为 (求具体数值),焓变ΔH 0(填“>”、“=”或“<”),若已知该反应仅在高温时正反应自发,则ΔS 0(填“>”、“=”或“<”)。
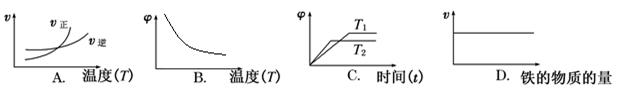
(3)下列图像符合反应②的是 (填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。
5、选择题 某温度下,在一个2?L的密闭容器中,加入4?mol?A和2?mol?B进行如下反应:3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6?mol?C,下列说法正确的
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6?mol?C,下列说法正确的
[? ]
A.?该反应的化学平衡常数表达式是
B.?此时B的平衡转化率是40%
C.?增大该体系的压强,平衡向右移动,化学平衡常数增大
D.?增加B,平衡向右移动,B的平衡转化率增大