微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在H2O2分解实验中,当加入少量MnO2粉末时,H2O2的分解速率增大。该实验中使H2O2分解速率增大的主要因素是
A.温度
B.催化剂
C.反应物的接触面积
D.反应物的浓度
2、实验题 (12分)为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜和稀硝酸反应的产物。
实验装置如图,气密性已检查。

已知:FeSO4+NO=[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是 。
(2)铜片和稀硝酸反应的化学方程式为 。
(3)本实验A生成的气体中,若有NO2,B的实验现象为 ;若只有NO生成,B的实验现象是 。
实验二 探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度<6 mol?L-1,只有NO生成。当铜片与5 mol?L-1硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如下图表。
时间/min
| 现象
|
0~15
| 铜表面出现气泡,但速度很慢
|
25
| 溶液有很浅的蓝色,气泡生成速度加快
|
30
| 气泡生成速度较快,均匀冒出
|
45
| 洗气瓶中可见少量淡棕色的物质
|
50
| 溶液中蓝色明显变深,洗气瓶中突显明显棕色
|
(4)获得图2数据所需的测量仪器有________________________________。
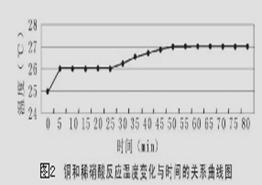
(5)从上述图表分析可得到的结论是 。
序号
| 温度
| 铜片/g
| 硝酸/mL
| 硝酸铜/g
|
1
| 25℃
| ①
| ②
| ③
|
2
| 25℃
| 5
| 20
| 0.5
|
3
| 25℃
| 5
| 20
| 1.0
|
探究二:研究化学反应产物对反应速率的影响
设计了如下实验,利用上图装置测定溶液突显明显棕色的时间。
(6)请将上表中将实验1的实验条件填写完整① ② ③
(7)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是 &# 160;。
3、选择题 下列各组反应(表内物质均为反应物)刚开始时,放出H2速率最大的是
编号
| 金属(粉末状)
| 物质的量
| 酸的浓度
| 酸的体积
| 反应温度
|
A
| Al
| 0.1 mol
| 18.4 mol/L H2SO4
| 10 mL
| 60 ℃
|
B
| Mg
| 0.1 mol
| 3 mol/L HCl
| 10 mL
| 30 ℃
|
C
| Fe
| 0.1 mol
| 3 mol/L H2SO4
| 10 mL
| 60 ℃
|
D
| Mg
| 0.1 mol
| 3 mol/L H2SO4
| 10 mL
| 60 ℃
|
4、选择题 下列措施对增大反应速率明显有效的是(?)
A.铝在氧气中燃烧生成Al2O3,将铝粉改成铝片
B.铁与稀硫酸反应制氢气时,改用质量分数为98.3%的浓硫酸
C.锌与稀硫酸反应制氢气时,适当提高溶液的温度
D.钠与水反应时增大水的用量
5、选择题 一定量的Fe与足量的0.5mol