微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列热化学方程式中的△H能表示物质燃烧热的是(?)
A.2CO(g)+O2 (g)=2CO2(g)△H = ―556kJ·mol-1
B.CH4(g)+2O2(g)=CO2 (g)+2H2O (l)△H = ―890kJ·mol-1
C.2H2 (g)+O2(g)=2H2O(l)△H = ―571.6kJ·mol-1[
D.H2 (g)+Cl2(g)=2HCl(g)△H = ―184.6kJ·mol-1
参考答案:B
本题解析:燃烧热是指1 mol可燃物完全燃烧为稳定的氧化物所放出的能量,针对本题中液态水才是稳定的氧化物,答案为B
本题难度:一般
2、选择题 常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是

A.VNaOH=10mL时,溶液中存在C(Na+)=2C(H2T)+2C(H T—)+2C(T 2—)
B.VNaOH=20mL时,溶液中存在C(Na+)>C(HT—)>C(H+)>C(H2T)>C(T 2—)
C.VNaOH=30mL时,溶液中存在C(Na+)>C(HT—)>C(T 2—)>C(OH—)>C(H+)
D.VNaOH=40mL时,溶液中存在C(OH—)=C(HT—)+2C(H2T)+C(H+)
参考答案:D
本题解析:当VNaOH=10mL时,溶液中的溶质是NaHT和H2T,所以根据原子守恒可知,选项A不正确,应该是2C(Na+)=C(H2T)+C(H T—)+C(T 2—);当VNaOH=20mL时,溶液中的溶质是NaHT,根据图像可知溶液显酸性,这说明水解程度小于电离程度,所以应该是C(Na+)>C(HT—)>C(H+)>C(T 2—) >C(H2T),B不正确;VNaOH=30mL时,溶液中的溶质是NaHT和Na2T,同样根据图像可知溶液显酸性,所以C(Na+)>C(T 2—) >C(HT—)>C(H+)>C(OH—),C不正确;VNaOH=40mL时,溶液中的溶质是Na2T,则根据质子守恒可知,C(OH—)=C(HT—)+2C(H2T)+C(H+),选项D正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和创新思维能力。该题的关键是利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒。
本题难度:简单
3、选择题 在下列各微粒中,能使水的电离平衡向正方向移动,而且溶液的pH小于7是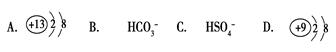
参考答案:A
本题解析:
正确答案:A
A、Al3+水解呈酸性,促进水电离,pH小于7,A正确;
B、水解,促进水电离,但pH大于7;
C、强电解质,抑制水电离;
D、F―水解,促进水电离,水解后,pH大于7.
本题难度:一般
4、选择题 下列比较中,正确的是(?)
A.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
B.0.2mol/L NH4NO3和0.1 mol/L NaOH溶液等体积混合后:
c(NH)>c(NO)>c(Na+)>c(OH-)>c(H+)
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH)
D.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH)由大到小的顺序是:①>②>④>③
参考答案:D
本题解析:略
本题难度:一般
5、选择题 常温下,浓度均为0.1000 mol / L的三种一元酸HX、HY、HZ,分别用0. 1000 mol/ L的NaOH溶液进行滴定,滴定曲线如图所示。下列有关叙述正确的是
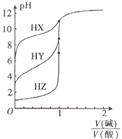
A.NaOH溶液与三种酸的反应均是吸热反应
B.滴定酸HY可用酚酞作指示剂
C.酸性强弱:HX>HY>HZ
D.滴定三种酸都可用甲基橙作指示剂
参考答案:B
本题解析:A.酸碱中和反应都是放热反应。错误。B.酸碱中和滴定选择指示剂时,为了减小实验误差,应该选择的指示剂的颜色变化由浅到深的为好。由于是用碱滴定酸,所以可用酚酞作指示剂。正确。C. 当酸的浓度相同时,酸越容易电离,则溶液中c(H+)越大,溶液的pH就越小。所以酸性HZ>HY>HX。错误。D. 滴定三种酸若都用甲基橙作指示剂,溶液的颜色变化是由红色变为橙色。颜色由深到浅。实验误差相对较大。应该用酚酞作指示剂为好。错误。
本题难度:一般