微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 元素的性质随着原子序数的递增呈现周期性变化的原因是( )
A.元素原子的核外电子排布呈周期性变化
B.元素原子的电子层数呈周期性变化
C.元素的化合价呈周期性变化
D.元素原子半径呈周期性变化
参考答案:A、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故A正确;
B、由原子的电子排布可知,随原子序数的递增,电子层数呈现周期性的变化,与元素性质的周期性变化有关,但不是唯一因素,而是电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故B错误;
C、化合价属于元素的性质,元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果,故C错误;
D、元素的原子半径属于元素的性质,元素的原子半径的周期性变化是电子排布周期性变化的结果,故D错误.
故选A.
本题解析:
本题难度:简单
2、简答题 已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增.A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小.则:
(1)A、B、C、D、E、F的名称分别是______.
(2)在A至F中任选元素,写出二种含极性键的非极性分子的结构式______,写出一种含非极性键的离子化合物的电子式______.
(3)由B和D组成,且B和D的质量比为3:8的化合物的电子式是______,该物质与E的同周期相邻主族元素的单质反应的化学方程式为______
(4)F单质与E的最高价氧化物的水化物反应的离子方程式为______.
(5)将8g?BA4完全燃烧后恢复到室温,放出热量a?kJ,写出表示BA4的燃烧热的热化学方程式______.
参考答案:(3)A原子的电子层数与它的核外电子总数相同,应为H元素,B原子的最外层电子数是次外层的2倍,应为C元素,C的氢化物可使湿润的红色石蕊试纸变蓝,应为N元素,形成的氢化物为氨气,为碱性气体,B和D可以形成两种气态化合物,应分别为CO和CO2,则D为O元素,E原子核外电子总数比B的2倍v3,则E的原子序数为33,应为Na元素,A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增,且F在本周期元素中原子半径最小,应为Cl元素,
所以A、B、C、D、E、F的名称分别是氢、碳、氮、氧、钠、氯,
故答案为:氢、碳、氮、氧、钠、氯;
(2)在A至F中任选元素,含极性键的非极性分子有等CO2、CH4、CCl4,对应结构式分别为O=C=O、
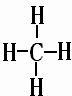
、
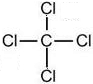
,含非极性键的离子化合物为Na2O2,电子式为
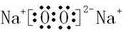
,
故答案为:O=C=O、
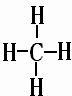
、

(任写两种);
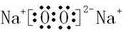
;
(3)由C和O组成,且C和O的质量比为3:个的化合物为CO2,电子式为

,与Na的同周期相邻主族元素为Mg,二者反应的化学方程式为CO2+2Mg?点燃?.?C+2MgO,
故答案为:

;CO2+2Mg?点燃?.?C+2MgO;
(4)Cl2与NaOH溶液反应生成NaClO和水,反应的离子方程式为2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:2OH-+Cl2=Cl-+ClO-+H2O;
(a)n(CH4)=个g36g/mol=个.amol,完全燃烧后恢复到室温,放出热量a?kJ,则3mol完全燃烧放出2akJ热量,所以表示CH4的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2akJ/mol.
本题解析:
本题难度:一般
3、填空题 现有部分1~18号元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构
T
M层上有6个电子
X
最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
元素最高正价是+7价
|
(1)写出元素T离子结构示意图______,元素X的一种同位素可测定文物年代,这种同位素的符号是______;
(2)元素Y与氢元素形成某阳离子,写出该阳离子的化学式______.
(3)元素Z与元素T相比,非金属性较强的是______(用元素符号表示).
(4)T、X、Y、Z四种元素的最高价氧化物的水化物的酸性最强的是______(用元素符号表示).
参考答案:(1)硫离子的结构示意图为:

,用来测定文物年代的原子是14C,故答案为:

;14C;
(2)氮与氢元素形成阳离子为NH4+,故答案为:NH4+;
(3)因同一周期从左到右,元素的非金属性逐渐增强,氯的非金属性大于硫;故答案为:Cl;
(4)因同一周期从左到右,元素的非金属性逐渐增强,元素的非金属性越强,其最高价氧化物的水化物的酸性越强,所以最高价氧化物的水化物的酸性最强的是HCl04,故答案为:HCl04.
本题解析:
本题难度:一般
4、填空题 现有A、B、C、D、E五种核电荷数小于18的元素,其中:A原子核内无中子,B原子最外层电子数是次外层的2倍,C原子最外层电子数是其电子层数的3倍,D原子核外K层比M层电子数多1,,E形成的-1价离子与Ar原子核外电子排布相同;
由此推知:
(1)A原子符号是______;
(2)B原子结构示意图是______
(3)E元素形成的单质与A、C、D三元素形成呈碱性的化合物反应的方程式:
______.
参考答案:由题意可知:A为H元素,B为C元素,C为O元素,D为Na元素,E为Cl元素,
(1)因A为H元素,则A原子符号是11H,故答案为:11H;
(2)B为C元素,C原子结构示意图为:
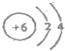
,故答案为:
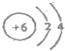
;
(3)E的单质为Cl2,A、C、D三元素形成呈碱性的化合物为NaOH,两者反应的方程式:2NaOH+Cl2═NaCl+NaClO+H2O,故答案为:2NaOH+Cl2═NaCl+NaClO+H2O.
本题解析:
本题难度:一般
5、选择题 元素性质呈周期性变化的决定因素是( )
A.元素相对原子质量依次递增
B.元素的最高正化合价呈周期性变化
C.元素原子电子排布呈周期性变化
D.元素金属性或非金属性呈周期性变化
参考答案:A、元素的原子的相对原子质量增大,但不呈现周期性的变化,则不能决定元素性质出现周期性变化,故A错误;
B、元素的最高正化合价的周期性变化是原子的电子排布周期性变化的结果,化合价属于元素的性质,故B错误;
C、由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,
即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故C正确;
D、元素金属性或非金属性都属于元素的性质,不能解释元素性质周期性变化的原因,故D错误;
故选:C.
本题解析:
本题难度:简单