微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (共12分)实验室里通常用MnO2与浓盐酸在加热的条件下反应制取氯气,为进行有关氯气的性质实验,需要4瓶容积为100ml的氯气(标准状况)。
(1)写出实验室制取氯气的化学反应方程式并标出电子转移的方向及数目。
(2)制取4瓶氯气,理论上需要MnO2固体的质量是多少?(浓盐酸过量,并可以补充)
(3)实际称量的MnO2固体的质量必需多于理论量,主要原因是什么?
参考答案:(共12分)
(1)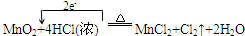 (方程2分,方向数目2分)
(方程2分,方向数目2分)
(2)n(Cl2)= =
=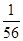 mol(或0.018mol)
mol(或0.018mol)
m(MnO2)= 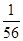 mol×87g/mol=1.55g(或1.6g)(4分)
mol×87g/mol=1.55g(或1.6g)(4分)
(3)所产生的氯气不可能完全被收集、利用。(4分)
本题解析:(2)所需氯气总量为400ml,即0.4L,设所需量为m
MnO2? +4HCl = MnCl2? +Cl2 ↑ +2H2O
87g? 22.4L
m? 0.4L
即:87*0.4L=22.4L*m?解得:m=1.55g。
(3)随着反应的进行,HCl的浓度逐渐降低,反应无法继续。另外因为在收集气体时要浪费部分气体去排除集气瓶内的气体,所以实际所需的气体量是大于400毫升的,那么所需的反应物固体自然就要大于理论值了。
点评:本题重点考查的是关于氯气的相关计算,发生的反应源自于课本,考查学生的计算能力和对课本知识的掌握程度。
本题难度:一般
2、填空题 硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺。
I尾气的吸收和综合利用。
以工业制硫酸的尾气、氨水、石灰石、焦炭、碳酸氯铵和KCI为原料可以合成硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
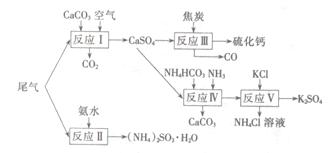
(1)反应III中氧化剂与还原剂的物质的量之比为?。
(2)反应Ⅳ的化学方程式为?。
(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为?。
Ⅱ催化剂的回收利用。
SO2的催化氧化所使用的催化剂为V2O5,实际生产中,催化剂在使用一段时间后,会含有V2O5、VOSO4和SiO2等,其中VOSO4。能溶于水。回收V2O5,的主要流程如下:
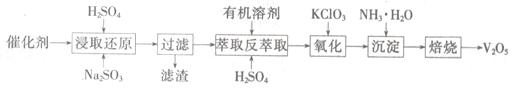
(4)若反萃取使用的硫酸用量过大,进一步处理时会增加____?的用量。
(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为?。
氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为?。
参考答案:(1)1︰4
(2)NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4
(3)K2SO4在40%的乙二醇溶液中溶解度更小
(4)NH3?H2O
(5)Na2SO3+V2O5+2H2SO4= 2VOSO4 +Na2SO4+2H2O ,? 2︰3。
本题解析:(1)反应III的化学方程式为:CaSO4+4C CaS+4CO↑.在该反应中CaSO4作氧化剂,C作还原剂,它们的物质的量的比为1︰4 。(2)由框图中的信息可知反应Ⅳ的化学方程式为NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4。(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为K2SO4在40%的乙二醇溶液中溶解度更小。(4)若反萃取使用的硫酸用量过大,为中和硫酸消耗的氨水就会增多。所以进一步处理时会增加NH3?H2O的用量。(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为Na2SO3+V2O5+2H2SO4= 2VOSO4 +Na2SO4+2H2O。氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为12:(7×6-12×2)=2:3.
CaS+4CO↑.在该反应中CaSO4作氧化剂,C作还原剂,它们的物质的量的比为1︰4 。(2)由框图中的信息可知反应Ⅳ的化学方程式为NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4。(3)反应V在25℃、40%的乙二醇溶液中进行,该反应能顺利进行的原因为K2SO4在40%的乙二醇溶液中溶解度更小。(4)若反萃取使用的硫酸用量过大,为中和硫酸消耗的氨水就会增多。所以进一步处理时会增加NH3?H2O的用量。(5)浸取还原过程的产物之一是VOSO4,反应的化学方程式为Na2SO3+V2O5+2H2SO4= 2VOSO4 +Na2SO4+2H2O。氧化过程的化学方程式为KClO3+6VOSO4+3H2SO4= 2(VO)2(SO4)3+KCl+3H2O;若两步所用试剂Na2SO3与KC1O3的物质的量之比为12:7,则该催化剂中V2O5、VOSO4的物质的量之比为12:(7×6-12×2)=2:3.
本题难度:一般
3、选择题 设NA 代表阿伏加德罗常数(NA )的数值,下列说法正确的是
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA 个氢原子
C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+
参考答案:C
本题解析:K2SO4中阴离子为硫酸根,1mol硫酸根所带电荷为2mol,A错误。乙烯和C3H6的最简式相同均为CH2,28g混合气有2molCH2,所以含4molH原子,B错误。Fe3+在溶液中发生水解,0.1molFeCl3溶液中,Fe3+的物质的量要小于0.1mol,D错误。
本题难度:简单
4、选择题 设NA 代表阿伏加德罗常数的数值,下列说法正确的是 (? )
A.28g以任意比组成的CO与N2混合气体中含有2NA 个原子
B.22.4L H2的分子数为NA
C.1mol FeCl3充分反应,生成的Fe(OH)3胶体中胶粒数目为NA 个
D.1L 1mol/L 的盐酸溶液中有NA个HCl分子
参考答案:A
本题解析:略
本题难度:简单
5、选择题 有FeO、 Fe2O3的混合物若干克,在CO气流中加热充分反应,冷却后称剩余固体比原混合物质量减轻0.8 g,若将同质量的混合物与盐酸反应,欲使其完全溶解需1 mol/L 的盐酸的体积为
A.200mL
B.100mL
C.50mL
D.无法计算