微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
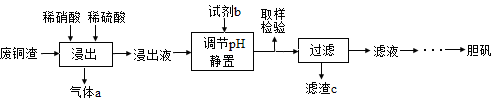 ?
?
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:?。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是?。
(3)滤渣c是?。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为:
2NO+O2 =2NO2、?。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式:?。
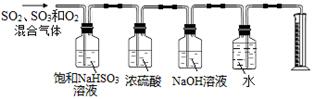
某同学设计了如下图所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:?。
参考答案:共12分。
(1)3Cu + 2HNO3 + 3H2SO4 =3CuSO4 + 2NO↑+ 4H2O(2分)
(2)向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净(2分)
(3)Fe(OH)3(2分)
(4)3NO2+H2O=2HNO3+NO(2分)
(5)3CuSO4 3CuO + SO3↑+ 2SO2↑+ O2↑(合理答案均可)(2分)
3CuO + SO3↑+ 2SO2↑+ O2↑(合理答案均可)(2分)
NaHSO3除了吸收SO3外和还吸收部分O2(合理答案均可)(2分)
本题解析:(1)根据氧化还原反应理论,铜与稀硫酸、稀硝酸的混合液反应生成硫酸铜、一氧化氮、水,化学方程式为3Cu + 2HNO3 + 3H2SO4 =3CuSO4 + 2NO↑+ 4H2O;
(2)Fe3+的检验方法是:向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净;
(3)废铜渣中含有杂质铁,所以调节pH目的是使铁离子沉淀,则滤渣c是Fe(OH)3;
(4)气体a是NO,NO与氧气反应生成二氧化氮,二氧化氮溶于水又得硝酸和NO,化学方程式为3NO2+H2O=2HNO3+NO;
(5)硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,配平方程式得3CuSO4 3CuO + SO3↑+ 2SO2↑+ O2↑;饱和NaHSO3溶液不吸收二氧化硫,但可以与三氧化硫反应又生成二氧化硫,导致二氧化硫质量增大。
3CuO + SO3↑+ 2SO2↑+ O2↑;饱和NaHSO3溶液不吸收二氧化硫,但可以与三氧化硫反应又生成二氧化硫,导致二氧化硫质量增大。
本题难度:一般
2、填空题 下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法。填表(填入序号):
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液。
C:(1)变性;(2)盐析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气。
物质
| 加入试剂
| 操作方法
|
①苯(苯甲酸)
| ?
| ?
|
②乙烷(乙烯)
| ?
| ?
|
③肥皂(甘油)
| ?
| ?
|
④乙醇(水)
| ?
| ?
|
⑤乙酸乙酯(乙酸)
| ?
| ?
参考答案:
物质
加入试剂
操作方法
①苯(苯甲酸)
(2)
(4)
②乙烷(乙烯)
(6)
(6)
③肥皂(甘油)
(1)
(2)
④乙醇(水)
(4)
(3)
⑤乙酸乙酯(乙酸)
(5)
(4)
本题解析:苯甲酸能和氢氧化钠溶液反应生成可溶性的苯甲酸钠,然后分液即可;乙烯能和溴水发生加成反应,洗气即可;肥皂中的甘油通过加入氯化钠,进行盐析即可;乙醇中的水加入新制的生石灰,蒸馏即可;乙酸乙酯不溶于水,加入饱和碳酸钠溶液即可除去乙酸,然后分液即可。
点评:分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:①分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解),溶解,过滤(洗涤沉淀),蒸发,结晶(重结晶);②分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏;③分离提纯物是胶体:盐析或渗析;④分离提纯物是气体:洗气
本题难度:一般
3、选择题 鉴别NaHCO3溶液和Na2CO3溶液,下列实验方案正确的是(?)
A.用NaOH溶液
B.用加热的方法
C.用澄清石灰水
D.用BaCl2溶液或CaCl2溶液
参考答案:D
本题解析:结合NaHCO3溶液和Na2CO3溶液的化学性质知:A项中没有明显的现象;B项由于所鉴别的是溶液,加热时溶液不会分解;C项中均有白色沉淀;D项中用BaCl2溶液或CaCl2溶液,NaHCO3溶液中没有明显现象,Na2CO3溶液中有白色沉淀产生。
本题难度:简单
4、选择题 4℃时,25滴水为amL,则1滴水中含有的水分子数为
A.aNA/25
B.aNA/(25×18)
C.aNA/(25×20)
D.aNA/(1000×22.4)
参考答案:B
本题解析:
本题难度:简单
5、填空题 银氨溶液放久后会产生叠氮化银(AgN3)而引起爆炸,直接排放会污染环境,且造成银资源的浪费。某研究小组设计了从银镜反应后的废液中(含过量的银氨溶液,假设不含单质银)回收银的如下两种实验流程:
(已知:[Ag(NH3)2]+在溶液中存在平衡:[Ag(NH3)2]+?Ag++2NH3)

(1)写出甲方案第①步废液与稀HNO3反应的离子方程式?。
(2)甲方案第②步加入的铁粉要过量的目的是?。
甲方案流程可能产生的大气污染物是?。
(3)乙方案若最终得到银粉的质量偏大,排除未洗涤干净的因素,可能的原因是?。
(4)实验室配制银氨溶液的操作过程是?。
(5)已知乙方案第③步反应有H2S气体产生,若最终得到银粉21.6 g,不考虑其他损失,理论上该步需要加入铁粉?g。
参考答案:(1)Ag[(NH3)2]++OH-+3H+=Ag++2NH4++H2O
(2)使溶液中的Ag+全部被还原 NO
(3)铁粉或Ag2S未反应完混于其中
(4)在洗净的试管中,注入1 mL AgNO3溶液,然后逐滴加入氨水,边滴边振荡,直到最初生成的沉淀刚好溶解为止(没有强调“洗净”不算全对,氨水与AgNO3具体浓度不作要求)
(5)5.6
本题解析:甲方案可解读为:向银氨溶液中加入稀硝酸,使平衡([Ag(NH3)2]+?Ag++2NH3)右移,破坏银氨溶液,再加入过量铁粉置换Ag+,最后加入过量稀盐酸溶解过量的铁粉,过滤、洗涤得银粉。但此方案中过量的稀硝酸可能与铁反应生成污染性气体NO。乙方案可解读为:向银氨溶液中加入(NH4)2S使Ag+转化为Ag2S沉淀,获取Ag2S后与浓盐酸、铁粉加热煮沸使发生反应:Ag2S+2HCl+Fe=2Ag+FeCl2+H2S,由方程式看出,要获得0.2 mol Ag,需要加入0.1 mol Fe。
本题难度:一般
|