微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)某研究性学习小组在实验室中配制1 mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________。
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60 mL 的稀硫酸标准溶液,配制时应选用100 mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、配制溶液时,若在最后一次读数时俯视读数,则导致最后实验结果偏大。
F、中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大。
(2)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH=?;写出该酸(HA)与NaOH溶液反应的离子方程式:?;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:?;
③0.2 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合后所得溶液中:
c(H+)+c(HA)-c(OH-)=?mol·L-1。(溶液体积变化忽略不计)
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw= ?。
①该温度下(t℃),将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=?。
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:?。
参考答案:(12分)(1)ABD (2分)?
(2) ①3? HA+OH ===A
===A +H2O? ②c(A
+H2O? ②c(A )>c(Na+)>c(H+)>c(OH
)>c(Na+)>c(H+)>c(OH )? ③0.05?各1分
)? ③0.05?各1分
(3)10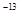 ?(2分)? ①12 (2分)? ②pHa+pHb=12(2分)
?(2分)? ①12 (2分)? ②pHa+pHb=12(2分)
本题解析:(1)容量瓶中含有少量蒸馏水,不会影响溶质和溶剂的质量,所以不影响实验结果,C不正确;配制溶液时,若在最后一次读数时俯视读数,则浓硫酸的体积偏小,导致最后实验结果偏低,D不正确;中和滴定时,若在最后一次读数时俯视读数,则消耗硫酸的体积减小,导致最后实验结果偏小,F不正确,其余选项都是正确的,答案选ABD。
(2) ①根据水的离子积常数可知,如果c(OH-) / c(H+)=1×10-8,则溶液中OH-离子浓度是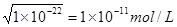 。则氢离子浓度是0.001mol/L,所以pH=3,这说明HA是弱酸,所以和氢氧化钠反应的离子方程式是HA+OH
。则氢离子浓度是0.001mol/L,所以pH=3,这说明HA是弱酸,所以和氢氧化钠反应的离子方程式是HA+OH ===A
===A +H2O。?
+H2O。?
②由于HA是弱酸,所以pH=3的HA溶液的浓度大于0.001mol/L,则在和氢氧化钠的反应中HA是过量的,因此反应后溶液显酸性,则离子浓度大小顺序是c(A )>c (Na+)>c(H+)>c(OH
)>c (Na+)>c(H+)>c(OH ) 。
) 。
③0.2 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合后,酸是过量的,所以根据电荷守恒定律和物料守恒可知,c(Na+)+c(H+)=c(OH )+c(A
)+c(A )、2c(Na+)=c(HA)+c(A
)、2c(Na+)=c(HA)+c(A )。则c(H+)+c(HA)-c(OH-)=c(Na+)=0.05mol/L。
)。则c(H+)+c(HA)-c(OH-)=c(Na+)=0.05mol/L。
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则0.01=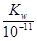 ,解得该温度下水的离子积常数Kw=10
,解得该温度下水的离子积常数Kw=10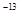 。
。
①硫酸和氢氧化钠的物质的量是0.01mol和0.04mol,则氢氧化钠是过量的,所以溶液中OH-浓度是(0.04mol-0.02mol)÷0.2L=0.1mol/L,则溶液中氢离子浓度是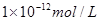 ,即pH=12。
,即pH=12。
②1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则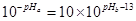 ,解得pHa+pHb=12。
,解得pHa+pHb=12。
点评:在比较溶液中离子浓度大小时,应该充分利用好电荷守恒定律、质子守恒以及物料守恒等关系式。其次在利用水的离子积常数进行有关计算时,必需注意水的离子积常数与温度有关系,由于电离是吸热的,所以水的离子积常数随温度的升高而增大,只有在常温常压下pH=7的溶液才是显酸性的。
本题难度:一般
2、选择题 在有乙离子存在的条件下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙不合理的是(在实验过程中不允许加热、过滤等操作)
选项
| 试剂丙
| 甲离子
| 乙离子
|
A
| HNO3、BaCl2
| SO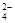
| SO [ [
|
B
| HNO3、AgNO3
| Cl?
| CO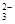 [ [
|
C
| HCl
| SiO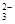
| CO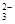
|
D
| NH3、H2O
| Mg2+
| Ag?
参考答案:A
本题解析:
本题主要考查对相关离子的检验。在备考中应特别注意,常见离子的检验试剂以及对干扰离子的排除。
在此题中,应明确甲离子是检验离子,而乙离子是干扰离子。对于A选项,HNO3会将SO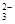 氧化成SO 氧化成SO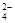 ,无论溶液中是否含有甲离子,溶液都会出现沉淀现象。因此A选项所加试剂不合理,应改用稀盐酸而不用具有氧化性的硝酸。对于B选项,加入硝酸,可以排除碳酸根离子的干扰;对于C选项,加入试剂后,可除去干扰离子,同时,出现沉淀现象,即可判断溶液中存在甲离子;对于D选项,干扰离子Ag+能与氨水形成络合物氢氧化二氨合银,而溶液中存在甲离子时,则会出现沉淀现象。 ,无论溶液中是否含有甲离子,溶液都会出现沉淀现象。因此A选项所加试剂不合理,应改用稀盐酸而不用具有氧化性的硝酸。对于B选项,加入硝酸,可以排除碳酸根离子的干扰;对于C选项,加入试剂后,可除去干扰离子,同时,出现沉淀现象,即可判断溶液中存在甲离子;对于D选项,干扰离子Ag+能与氨水形成络合物氢氧化二氨合银,而溶液中存在甲离子时,则会出现沉淀现象。
本题难度:一般
3、填空题 (1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH)??c(NaOH )(填“<、=或>”,下同);混合后溶液的pH?7。
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为?。(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是?;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是?;③室温下,若生成同浓度的NaCl与NH4Cl溶液各1L,则溶液中离子总数N(NaCl)?N(NH4Cl)。(填“<、=或>”)
参考答案:(1)①>;<(每空1分) ②M++H2O MOH+H+(2分) MOH+H+(2分)
(2)V1=V2<V3;V1>V2>V3;>(每空2分)
本题解析:(1)①醋酸是弱酸,存在电离平衡,因此pH=4的醋酸溶液的浓度大于10-4mol/L。氢氧化钠是强碱,完全电离,则常温下pH=10的氢氧化钠溶液浓度等于10-4mol/L,因此混合前c(CH3COOH)>c(NaOH );两者等体积混合后醋酸过量,溶液显酸性,所以混合后溶液的pH<7。
②由于a+b=14,两者等体积混合后溶液显碱性,若溶液是由于水解显碱性,则酸一定是弱酸。但如果算是弱酸,则酸一定过量,溶液应该显酸性,才假设不正确。所以只能是碱过量导致溶液显碱性,因此碱是弱碱,则生成的盐中M+水解,该水解反应的离子方程式为M++H2O MOH+H+。 MOH+H+。
(2)①氢氧化钡和氢氧化钠是强碱,在溶液体积和pH相等的条件下消耗的盐酸的物质的量相同,所以在盐酸的浓度相等的条件下,消耗盐酸的体积是V1=V2;氨水是弱碱,存在电离平衡,所以在pH相等的条件下氨水的浓度大于氢氧化钠溶液的浓度,消耗的盐酸体积最多,因此V1、V2、V3的大小关系是V1=V2<V3;
②氢氧化钡和氢氧化钠是强碱,在溶液体积和物质的量浓度相等的条件下消耗的盐酸的物质的量前者多,因此在盐酸的浓度相等的条件下,消耗盐酸的体积是V1>V2;氨水是弱碱,与盐酸恰好反应时溶液显酸性,若要显中性,则氨水应该是过量的,所以消耗盐酸的体积应该是V2>V3,则V1、V2、V3的大小关系是V1>V2>V3;
③由于氯化铵溶液中NH4+水解,而钠离子不水解,所以等体积等浓度的NaCl与NH4Cl溶液中离子总数大小关系是N(NaCl) >N(NH4Cl)。
本题难度:一般
4、选择题
A.0.045 mol·L-1
B.0.035 mol·L-1
C.0.055 mol·L-1
D.0.040 mol·L-1
参考答案:B
本题解析:该溶液中离子有SO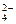 、Al3+、H+、K+,已知前三者的浓度,由溶液中阴离子带的负电荷数一定等于阳离子带的正电荷数即可求出K+的浓度。 、Al3+、H+、K+,已知前三者的浓度,由溶液中阴离子带的负电荷数一定等于阳离子带的正电荷数即可求出K+的浓度。
本题难度:简单
5、填空题 取两支试管,分别加入4mL0.01mol/L的KMnO4溶液,然后向试管①中加入0.1mol/LH2C2O4溶液2mL,记录溶液褪色所需的时间;向试管②中加入0.2mol/L H2C2O4溶液2mL,记录溶液褪色时间,(1)实验表明 褪色更快些。
(2)写出反应的化学方程式 。
(3)在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- ⑥C2O42-、Br-、K+、Cl-
参考答案:
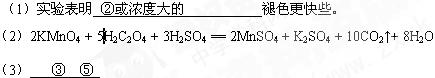
本题解析:略
本题难度:困难
|