微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知硫酸在水中的电离方程式是:H2SO4═?H+?+?HSO4-,?HSO4-? H++SO42-,回答下列问题:
H++SO42-,回答下列问题:
(1)Na2SO4溶液显_______(填“酸性”,“中性”或“碱性”)。理由是__________(用离子方程式表示)?。
(2)在0.1?mol/L的Na2SO4溶液中,下列微粒浓度关系正确的有________。
A.c(SO42-)+c(HSO4-)+c(H2SO4)=0.1?mol/L?
B.c(OH-)=c(H+)+c(HSO4-)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(3)如果25?℃时,0.1?mol/L的NaHSO4溶液中c(SO42-)=0.029?mol/L,则0.1?mol/LH2SO4溶液中c(SO42-)_____0.029?mol/L(填“<”,“>”或“=”),理由是_________________。
(4)0.1?mol/LNaHSO4溶液中各种离子浓度由大到小的顺序是:________________。
(5)如果25?℃时,0.10?mol/LH2SO4溶液的pH=-lg?0.11,?则25?℃时,0.10?mol/L的H2SO4溶液中c(SO42-)=____________。
参考答案:(1)碱性;SO42-+H2O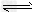 HSO4-+OH-
HSO4-+OH-
(2)BCD
(3)<;H2SO4第一步电离产生的H+,抑制了HSO4-
(4)c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH-)
(5)0.010 mol·L-1
本题解析:
本题难度:一般
2、选择题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①_________②___________ ③__________。
(2)溶液中共有________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol/L的是_________,浓度为0.002mol/L的是_________。
(4)__________和___________两种粒子物质的量之和等于0.01mol。
参考答案:(1)CH3COO-+H2O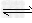 CH3COOH+OH-;CH3COOH
CH3COOH+OH-;CH3COOH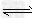 CH3COO-+H+;?H2O
CH3COO-+H+;?H2O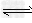 OH-+H+;
OH-+H+;
(2)7;
(3)Na+;Cl-;
(4)CH3COOH;CH3COO-
本题解析:
本题难度:一般
3、选择题 下列说法不正确的是
?[?]
A.100℃时,纯水中c(H+)=1×10-6 mol·L-1,pH小于7,此时纯水显酸性
B.25℃时,pH=12的烧碱和氢氧化钡溶液,二者物质的量浓度之比为2:1
C.25℃时,pH=3的盐酸与pH=5的硫酸等体积混合,混合液pH等于4
D.25℃时,0.1 mol·L-1 CH3COOH溶液中,c(CH3COOH)>c(CH3COO-)
参考答案:AC
本题解析:
本题难度:一般
4、填空题 (1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为______.
(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):
①溶液中c(NH
)+c(NH3?H2O)一定等于______
②溶液中n(OH-)+n(Cl-)-n(NH+4)=______.
参考答案:(1)已知,0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12说明CN-的水解程度大于HCN的电离程度;将0.2mol?L-1HCN溶液和0.1mol?L-1的NaOH溶液等体积混合后,溶液溶质为HCN和NaCN,二者浓度相等,溶液显碱性,说明CN-水解程度大于HCN电离程度,溶液中离子浓度大小关系为:C(Na+)>C(CN-)>C(OH-)>C(H+);
故答案为:C(Na+)>C(CN-)>C(OH-)>C(H+
(2)(1)NH4Cl+NaOH═NH3.H2O+NaCl
? 反应前 0.01mol 0.002mol
? 反应 0.002mol 0.002mol? 0.002mol? 0.002mol
? 反应后0.008mol? ?0? 0.002mol? 0.002mol
所以溶液中的溶质是NH4Cl、NH3.H2O、NaCl;
①无论NH4+水解程度和 NH3.H2O的电离的程度如何,但遵守物料守恒,即NH4+和 NH3.H2O的物质的量之和为0.01mol,故答案为;0.02mol;
②溶液中阴阳离子所带电荷相同,溶液中存在的离子为Na+、Cl-、NH4+、OH-、H+,
即n(Na+)+n(NH4+)+n(H+)=n(Cl-)+n(OH-),
溶液中n(OH-)+n(Cl-)-n(NH+4)=n(Na+)+n(H+),
故答案为:n(Na+)+n(H+).
本题解析:
本题难度:一般
5、选择题 已知HCN的电离常数K=6.2×10-10.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性.则下列关系式正确的是( )
A.c(CN-)>c(Na+)
B.c(CN-)>c(HCN)
C.c(HCN)+c(CN-)=0.2mol?L-1
D.c(CN-)+c(OH-)=0.1mol?L-1
参考答案:A.根据溶液电中性的原则,溶液中存在c(CN-)+c(OH-)=c(Na+)+c(H+),溶液呈碱性则有c(H+)<c(OH-),c(CN-)-)<c(Na+),故A错误;
B.混合溶液呈碱性,说明酸的电离程度小于酸根离子水解程度,则c(HCN)>c(CN-),故B错误;
C.溶液中存在c(CN-)+c(OH-)=c(Na+)+c(H+),因c(Na+)=0.1mol/L,依据物料守恒,则c(CN-)+c(OH-)=0.2mol/L,故C正确;
D.HCN和NaCN的物质的量都为1mol,由物料守恒可知c(CN-)+c(HCN)=0.2mol/L,故D错误.
故选C.
本题解析:
本题难度:一般