|
高中化学知识点大全《难溶电解质的溶解平衡》高频试题强化练习(2017年最新版)(二)
2017-07-10 18:38:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知CuSO4溶液分别与Na2CO3、Na2S溶液的反应情况如下:?据此判断,下列几种物质Ksp大小的比较中正确的是?
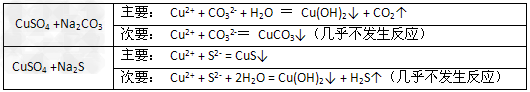
[? ]
A.Cu(OH)2<CuS?<CuCO3?
B.CuS?<Cu(OH)2<CuCO3?
C.CuCO3<Cu(OH)2<CuS?
D.CuCO3?<CuS?<?Cu(OH)2
参考答案:B
本题解析:
本题难度:一般
2、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
A.常温下,向100mL?CaSO4饱和溶液中,加入400mL?0.01mol/LNa2SO4溶液后,溶液中有沉淀析出
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
| 
参考答案:A.CaSO4饱和溶液c(Ca2+)=c(SO42-)=3×10-3mol/L,加入400mL 0.01mol/LNa2SO4溶液后,c(Ca2+)=0.6×10-3mol/L,c(SO42-)=8.6×10-3mol/L,Qc<Ksp,没有沉淀生成,故A错误;
B.d根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO4-)会小于4×l0-3mol/L,由于c(Ca2+)>c(SO42-),则c(SO4-)小于3×l0-3mol/L,故B错误;
C.升高温度,有利于溶解平衡正向移动,所以硫酸根的浓度会增大,故C错误;
D.Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D正确.
故选D.
本题解析:
本题难度:一般
3、填空题 (1)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为?。
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1 mol·L-1硫酸铝溶液;②0.1 mol·L-1氯化钡溶液;③蒸馏水;④0.1 mol·L-1硫酸溶液中,Ba2+浓度由大到小的顺序是?(用序号填写)。
(3)常温下,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合,当溶液中c(N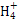 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=?。 )=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=?。
参考答案:(1)107∶1? (2)②>③>④>①? (3)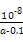
本题解析:(1)0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合,恰好生成NaA,水解促进水的电离,已知pH=8,故由水电离出的c(OH-)=10-6;NaOH抑制水的电离,0.1 mol·L-1 NaOH溶液的c(OH-)="0.1" mol·L-1,故由水电离出的c(OH-)=c(H+)=10-13,两者之比为107∶1。(2)一定温度下,c(S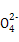 )·c(Ba2+)为定值,c(S )·c(Ba2+)为定值,c(S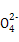 )越小,c(Ba2+)越大,故c(Ba2+)由大到小的顺序是②>③>④>①。(3)根据溶液电中性,c(H+)+c(N )越小,c(Ba2+)越大,故c(Ba2+)由大到小的顺序是②>③>④>①。(3)根据溶液电中性,c(H+)+c(N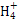 )=c(OH-)+c(Cl-),已知c(N )=c(OH-)+c(Cl-),已知c(N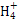 )=c(Cl-)= )=c(Cl-)=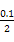 ?mol·L-1,故c(OH-)=c(H+)=10-7 mol·L-1。根据物料守恒,c(NH3·H2O)+c(N ?mol·L-1,故c(OH-)=c(H+)=10-7 mol·L-1。根据物料守恒,c(NH3·H2O)+c(N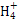 )= )= ?mol·L-1,故c(NH3·H2O)= ?mol·L-1,故c(NH3·H2O)=  - -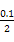  ?mol·L-1= ?mol·L-1=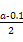 ?mol·L-1。代入Kb= ?mol·L-1。代入Kb=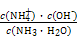 = =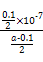 = =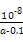 。 。
本题难度:简单
4、选择题 硫酸锶(SrSO4)在水中的溶解平衡曲线如图。下列说法正确的是( )

A.温度一定时,Ksp(SrSO4)随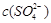 的增大而减小 的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时a点对应的溶液是不饱和溶液
D.283K下SrSO4饱和溶液升温到363K后变为不饱和溶液
参考答案:BC
本题解析:溶度积常数只与温度有关,A错误。根据图像可判断,当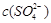 相同时,温度为313K时锶离子的浓度最大,因此选项B正确。A点不位于溶解度曲线上,所以是不饱和溶液,C正确。因为当 相同时,温度为313K时锶离子的浓度最大,因此选项B正确。A点不位于溶解度曲线上,所以是不饱和溶液,C正确。因为当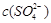 相同时,温度为363K时锶离子的浓度最小,所以283K下SrSO4饱和溶液升温到363K后将有晶体形成,溶液还是饱和溶液。答案选BC。 相同时,温度为363K时锶离子的浓度最小,所以283K下SrSO4饱和溶液升温到363K后将有晶体形成,溶液还是饱和溶液。答案选BC。
本题难度:简单
5、选择题 (1)某温度(t℃)时,测得0.01 mol·L-1?的NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw=??。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb=??。
(2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为?.?
参考答案:(1)①1.0×10-15?②10:1?(2)1.8×10-7mol/L。
本题解析:(1)①0.01 mol·L-1?的NaOH溶液的pOH=2,即pOH+ pH=15,即该温度下水的Kw=1.0×10-15?;
②所得混合液为中性即氢离子的物质的量与氢氧根离子的物质的量相等;即, ,又a=12,b=2,则Va︰Vb=10:1; ,又a=12,b=2,则Va︰Vb=10:1;
(2)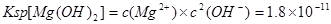 ;当溶液PH=12时即 ;当溶液PH=12时即 ,代入 ,代入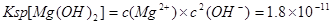 进而可得此时溶液中Mg2+的物质的量浓度为1.8×10-7mol/L。 进而可得此时溶液中Mg2+的物质的量浓度为1.8×10-7mol/L。
本题难度:简单
| 