微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 自然界中的物质多数是以混合物的形式存在,对于混合物的分离或提纯,常采用的方法有:过滤、蒸发、蒸馏、萃取、加热分解等。下列各组混和物的分离或提纯应采用什么方法?
①提取碘水中的碘,用_____________方法。
②除去食盐溶液中的水,可采用_____________的方法。
③氧化铜中含有铜绿[主要成分为碱式碳酸铜Cu2(OH)2CO3]可用________的方法
参考答案:①萃取、蒸馏?②蒸发。?③加热分解
本题解析:①提取碘水中的碘,因为碘在水中溶解度比在有机溶剂中小,所以用萃取法;②除去食盐溶液中的水,除去溶剂,选择蒸发法;③氧化铜中含有铜绿要用化学方法,铜绿加热分解可以生成氧化铜,采用加热法。
点评:常见的实验操作方法,较简单。
本题难度:一般
2、选择题 在标准状况下,O2和CO2的混合气体共6.72L,其质量为11.4g,则混合气体中氧气的质量分数是
A.21%
B.78%
C.50%
D.42.1%
参考答案:D
本题解析:试题分析:混合气体体积为6.72L,则混合气体的物质的量=6.72/22.4=0.3mol,则设氧气的物质的量为X,有X×32+(0.3-X) ×44=11.4,计算可得X=0.15,则氧气的质量=0.15×32=4.8g,质量分数为4.8/11.4×100%=42.1%。
考点:混合气体的物质的量计算
点评:本题涉及到了混合气体的物质的量计算,利用的还是根据已知条件来找条件,另外还要用到一条规律,不论是混合气体还是纯气体,只要在标况下,体积都是22.4L。
本题难度:简单
3、简答题 某化学兴趣小组以含铁的废铝为原料制备硫酸铝晶体,设计如下的实验方案:请回答以下问题:
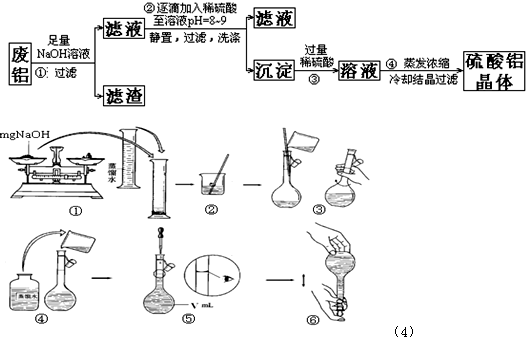
(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有______;
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净:______;
(3)评价步骤②的操作中难以控制之处______,请你提出一个合理而比较容易操作的实验方案(药品可任选)______,该反应的分子方程式为:______;
(4)步骤①中使用的NaOH溶液以4mol/L为宜.某同学称量mgNaOH固体配制V?m?L?4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中错误的是(填操作序号)______.
参考答案:(1)过滤实验用到的玻璃仪器有:烧杯、漏斗、玻璃棒,
故答案为:烧杯、漏斗、玻璃棒;
(2)洗涤沉淀不干净时,在沉淀表面会附着硫酸钠,硫酸根的检验方法:取最后一次洗涤液,加入几滴BaCl2溶液,若无白色沉淀生成则洗涤干净,
故答案为:取最后一次洗涤液,加入几滴BaCl2溶液,若无白色沉淀生成则洗涤干净;
(3)偏铝酸钠和少量的酸反应会生成氢氧化铝沉淀,酸稍过量,沉淀会溶解,但是让溶液的pH=8~9难以控制,可以向偏铝酸钠中通入过量CO2气体来制取氢氧化铝,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)①氢氧化钠易潮解,应在小烧杯中称量,故①错误;④在移液时,要用玻璃棒来引流,故④错误;⑤定容时视线要和刻度线相平,不能俯视和仰视,故⑤错误,
故答案为:①④⑤.
本题解析:
本题难度:一般
4、选择题 下列各组溶液,不用其它试剂,无法将它们区别开的是
A.HCl、CuSO4、Mg(NO3)2、KOH
B.NaBr、AgNO3、HCl、Na2CO3
C.H2SO4、NaCl、Na2SO4、Na2CO3
D.NaOH、MgSO4、Na2CO3、KHSO4
参考答案:C
本题解析:要对各组所给的各种物质进行合理分析,将其中一种与其他的反应只要每次现象不同就可以区分,则
A中硫酸铜在溶液中显蓝色,首先鉴别出来。硫酸铜和氢氧化钾反应生成蓝色沉淀氢氧化铜,进而鉴别出来氢氧化钾。氢氧化钾和硝酸镁反应生成白色沉淀氢氧化镁进而鉴别出来硝酸镁,剩余的是盐酸,可以鉴别。
B、
?
NaBr
AgNO3
?HCl
?Na2CO3
NaBr
?无现象
浅黄色沉淀
?无现象
?无现象
?AgNO3
?浅黄色沉淀
?无现象
?白色沉淀
?白色沉淀
?HCl
?无现象
白色沉淀
?无现象
?有气体产生
?Na2CO3
?无现象
白色沉淀
?有气体产生
?无现象
由于碳酸钠和盐酸反应是分布进行的,则二者的滴加顺序不同,实验现象不同,可以鉴别。
C、
?
?H2SO4
?NaCl
?Na2SO4
?Na2CO3
?H2SO4
?无现象
?无现象
?沉淀、气体
?产生气体
?NaCl
?无现象
?无现象
?无现象
?无现象
?Na2SO4
?无现象
无现象
?无现象
?无现象
Na2CO3
?产生气体
?无现象
?无现象
?无现象
根据上表可知,四组现象中的现象是相同的,不能鉴别。
D、
?
?NaOH
?MgSO4
?Na2CO3
?KHSO4
NaOH
?无现象
?白色沉淀
?无现象
?无现象
MgSO4
?白色沉淀
?无现象
?白色沉淀
?无现象
Na2CO3
?无现象
?白色沉淀
?无现象
?产生气体
?KHSO4
?无现象
?无现象
?产生气体
?无现象
根据上表可知,四组现象中是各不相同的,故可以用本组试剂互相鉴别,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型。试题综合性强,对学生的思维能力要求高,有利于培养学生规范、严谨的实验设计能力,明确物质的性质是答题的关键。该类实验需要注意的是在进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:一般
5、实验题 实验室制取乙酸丁酯的实验装置有以下甲、乙两种装置可供选用。
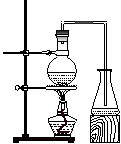 ?
?
(甲)?(乙)
制备乙酸丁酯所涉及的有关物质的物理性质见下表
?
| 乙酸
| 1-丁醇
| 乙酸丁酯
|
熔点(℃)
| 16.6
| -89.5
| -73.5
|
沸点(℃)
| 117.9
| 117
| 126.3
|
密度(g/cm3)
| 1.05
| 0.81
| 0.88
|
水溶性
| 互溶
| 可溶
(9g/100g水)
| 微溶
|
?
(1)制取乙酸丁酯的装置应选用___________(填“甲”或“乙”)。不选另一种装置的理由是______________________________________________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)________________________________________________________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
①?;②?
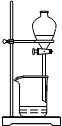
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是________________(选填答案编号)。
 ?
?
 ?
? ?
?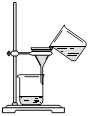
A? B? C? D
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须_______________,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有?。
参考答案:(1)乙。由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发。
(2)CH3CH2CH2CH2OCH2CH2CH2CH3 ?CH3CH2CH=CH2。
(3)①增加乙酸浓度?②减小生成物浓度(或移走生成物)。
(4)AB。
(5)检查是否漏水或堵塞,分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)。
本题解析:(1)应该选择乙。由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发。
(2)在浓硫酸加热条件下会生成副产物醚和发生消去反应,故为CH3CH2CH2CH2OCH2CH2CH2CH3 ?和CH3CH2CH=CH2。
(3)从化学平衡移动的角度分析可知①增加乙酸浓度?②减小生成物浓度(或移走生成物)可以使平衡右移,有利于酯的生成;
(4)前者主要是萃取选A后者是分液选择B。
(5)检查是否漏水或堵塞,分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)。
本题难度:一般