微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
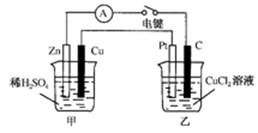
(1)甲装置的名称是_______;乙装置的名称是_______;Zn为_______极;Pt为______极。
(2)写出电极反应式:Cu极________________;C极________________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色______(填“变深”、“变浅”或“无变化”)。
(4) 若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将________。
参考答案:(1)甲装置名称是原电池;乙装置名称是电解池;Zn为负极;Pt为阳极。
(2) Cu极2H++2e-=H2↑;C极Cu2++2e-=Cu。
(3)乙中溶液的颜色无变化
(4)甲中溶液的pH将增大;乙中溶液的pH将增大
本题解析:(1)甲池为锌铜原电池,活性较强的锌做负极,铜为正极;与外电源正极相连的Pt电极为阳极,碳棒为阴极
(2)Cu极:2H++2e-=H2↑;?C极:Cu2++2e-=Cu
(3)乙池中电极都换成铜电极时,阳极:Cu—2e-=Cu2+;阴极:Cu2++2e-=Cu,即溶液中Cu2+的浓度不改变,溶液的颜色无变化
(4)甲池中总反应Zn+2H+=Zn2++H2↑,H+浓度减小,酸性减弱,pH增大;而乙池中总反应为:2Cl-+2H2O=H2↑+Cl2↑+2OH-,OH-离子浓度增大,碱性增强,pH增大
本题难度:一般
2、选择题 钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目不相等
B.反应①中还原剂是氢氧化亚铁
C.反应①属于析氢腐蚀
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
参考答案:
D
本题解析:略
本题难度:简单
3、选择题 钢铁发生吸氧腐蚀时,负极上发生的电极反应是
A.2H+ + 2e- ="==" H2↑
B.Fe == Fe2+ + 2e-
C.2H2O + O2 + 4e- ="==" 4OH-
D.Fe3+ + e- ="==" Fe2+
参考答案:B
本题解析:钢铁中含有碳、铁,根据原电池工作原理,活泼的金属作负极,不如负极活泼的金属或导电的非金属作正极,所以碳作正极,铁作负极;负极失电子变成离子进入溶液,正极上得电子发生还原反应,钢铁发生吸氧腐蚀时,负极上发生的电极反应Fe? ==? Fe2+ + 2e-
本题难度:简单
4、选择题 下列说法正确的是(? )
A.钢铁发生电化学腐蚀时,负极发生的反应是:Fe-3e-=Fe3+
B.将钢铁与电源的正极相连,可防止其被腐蚀
C.在镀件上镀铜时可用金属铜作阴极
D.用电解法精炼粗铜时粗铜作阳极
参考答案:D
本题解析:A项,钢铁发生电化学腐蚀时,负极发生的反应是:Fe-2e-=Fe2+,A错误;B项,将钢铁与电源的正极相连,作阳极,将加速腐蚀,B错误;C项,在镀件上镀铜时可用金属铜作阳极,C错误
本题难度:一般
5、选择题 如下图,铁腐蚀由快到慢的顺序为(电解质溶液为水)

A.⑥>④>③>②>①>⑤
B.⑤>③>①>②>④>⑥
C.⑤>④>①>②>③>⑥
D.⑤>④>②>①>③>⑥
参考答案:C
本题解析:正确答案:C
⑤铁作电解池的阳极腐蚀最快④铁作原电池的负极,加快腐蚀①在潮湿的空气中生锈②有油作保护③牺牲阳极的阴极保护⑥外加电流的阴极保护腐蚀最慢。
本题难度:一般