微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 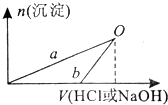 某同学研究铝及其化合物的性质设计了如下两个实验方案.
某同学研究铝及其化合物的性质设计了如下两个实验方案.
方案①:2.7gAl 100mLHCl? X溶液 NaOH 氢氧化铝沉淀
方案②:2.7gAl 100mLNaOH? Y溶液 HCl 氢氧化铝沉淀
NaOH和HCl的浓度均是3mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法不正确的是
A.b曲线表示的是向x溶液中加入NaOH溶液
B.在O点时两方案中所得溶液浓度相等
C.a、b曲线表示的反应都是非氧化还原反应
D.Y溶液显碱性
参考答案:A
本题解析:分析:能和氢氧化钠反应生成沉淀的是氯化铝,所以X是氯化铝溶液,能和盐酸反应生成沉淀的是偏铝酸钠,根据曲线b可以知道Y是氢氧化钠和偏铝酸钠的混合物,根据盐的水解知识可以判断溶液的酸碱性情况,在O点时,沉淀达到最大,所得溶液中只有氯化钠溶质,根据原子守恒可以确定两方案中所得溶液浓度.
解答:A、n(Al)=0.1 mol,n(HCl)=3 mol/L×0.1 L=0.3 mol,n(NaOH)=3 mol/L×0.1 L=0.3 mol,根据反应:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,X为AlCl3溶液,Y为NaAlO2和NaOH的混合液,因此,图象中a表示X溶液中加入的是NaOH溶液,故A错误;
B、在O点时,沉淀达到最大,所得溶液中只有氯化钠溶质,与向X溶液和Y溶液中分别加入NaOH和HCl的浓度及体积相等,根据原子守恒,所以O点时两方案中所得溶液浓度相等,故B正确;
C、a表示的是氯化铝和氢氧化钠的复分解反应,b表示的是偏铝酸钠和盐酸的反应,二反应不存在化合价的变化,均不属于氧化还原反应,故C正确;
D、Y是氢氧化钠和偏铝酸钠的混合物,偏铝钠水解显示碱性,氢氧化钠是强碱,所以Y溶液显碱性,故D正确.
故选A.
点评:本题考查学生铝及其化合物的性质方面的知识,注意知识的积累是解题的关键,难度大,综合性强.
本题难度:一般
2、选择题 将2molNaHCO3和一定量Na2O2固体混合,在加热条件下让其充分反应,150℃时所得气体中仅含有两种组分,则反应后固体的物质的量n的取值范围是
A.n=1mol
B.1molC.2molD.n≥4mol
参考答案:C
本题解析:2NaHCO3===(△)Na2CO3+CO2↑+H2O↑;2molNaHCO3生成1mol CO2和1mol H2O、1mol Na2CO3,Na2O2固体与混合气体反应可看成是先与CO2反应,反应完后再与H2O反应。
2Na2O2+2CO2="2" Na2CO3+ O2↑;2Na2O2+2 H2O ="4NaOH+" O2↑;要求反应后气体中含有两种组分,则两组分为氧气和水蒸气;过氧化钠与二氧化碳反应消耗的物质的量为1mol,生成Na2CO3的物质的量为1mol,若1mol H2O全部与Na2O2反应则生成2 mol NaOH,所以反应后固体的物质的量n的取值范围是2mol<n<4mol;
本题难度:一般
3、选择题 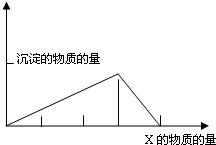 将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的量与加入X的物质的量关系如下图所示,符合图示情况的是
将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的量与加入X的物质的量关系如下图所示,符合图示情况的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:由图可知,将物质X逐渐加入(或滴入)Y溶液中,生成沉淀,当Y溶液反应完后,继续加入物质X,物质X能与沉淀反应而使生成的沉淀溶解,且生成沉淀所需要的X的物质的量与沉淀溶解需要的X的物质的量之比为3:1,据此解答.
解答:A、石灰水中通入二氧化碳,先发生反应Ca(OH)2+CO2═CaCO3↓+H2O,生成CaCO3沉淀,当Ca(OH)2溶液反应完后,再继续通入CO2发生反应CO2+CaCO3+H2O═Ca(HCO3)2沉淀消失,所以前后两个过程CO2的物质的量之比为1:1,故A错误;
B、偏铝酸钠溶液中加入盐酸,先发生反应AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,当偏铝酸钠溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+═Al3++3H2O,沉淀消失,所以前后两个过程HCl的物质的量之比为1:3,故B错误;
C、氯化铝溶液中加入氢氧化钠溶液中,先发生反应Al3++3OH-═Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失,所以前后两个过程氢氧化钠的物质的量之比为3:1,故C正确;
D、氢氧化钠溶液中滴入氯化铝溶液,先发生反应Al3++4OH-═AlO2-↓+2H2O,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应后发生3AlO2-↓+Al3++6H2O═4Al(OH)3↓+6H2O,生成沉淀溶,所以前后两个过程氯化铝的物质的量之比为3:1,故D错误.
故选:C
点评:本题考查化学反应与图象,难度较大,明确发生的化学反应及反应与图象的对应关系是解答的关键,要求学生有将图象信息转换为化学信息的能力,同时对化学知识必须十分熟练.
本题难度:简单
4、选择题 某溶液中滴入KSCN溶液后变红,说明溶液中存在
A.NO3-
B.SO42-
C.Fe3+
D.Mg2+
参考答案:C
本题解析:KSCN是用来检验三价铁离子,是三价铁离子变红色。
本题难度:一般
5、选择题 在4Zn+10HNO3(很稀)===4Zn(NO3)2+NH4NO3+3H2O的反应中,如果4?mol?Zn完全起反应,则被还原的HNO3的物质的量是
A.1mol
B.2 mol
C.4 mol
D.10 mol
参考答案:A
本题解析:
NH4NO3是还原产物,其中只NH4+中的N被还原,
4Zn?~?NH4+
4?1
4 mol →? 1mol?
故选A。
本题难度:困难