|
高考化学知识点总结《电解池原理》试题强化练习(2017年最新版)(四)
2017-07-10 18:54:43
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于电解精炼铜的叙述中不正确的是
A.粗铜板为阳极
B.粗铜所含Au、Ag、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
C.电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-=Cu
D.精铜的纯度可达99.95%~99.98%
|
参考答案:B
本题解析:A、精炼铜时,粗铜失电子,根据电解池工作原理,粗铜作阳极,精铜作阴极,说法正确;B、根据电解池工作原理,活动性金属作阳极,按照活动性强弱失电子,锌先失电子,然后是铁失电子,最后是铜失电子,金、银不参加反应,以单质形式沉积槽底,形成阳泥,错误;C、电解时,粗铜作阳极,反应式:Cu-2e-=Cu2+,化合价升高,发生氧化反应,阴极:Cu2++2e-=Cu,正确;D、精炼铜提高铜的纯度,纯度可达99.95%~99.98%,正确。
考点:考查精炼铜。
本题难度:一般
2、选择题 下列说法正确的是
A.电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离
B.强电解质与弱电解质的本质区别,是其水溶液导电性的减弱
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.常见的强酸、强碱和大部分盐都是强电解质,其他化合物都是非电解质
参考答案:A
本题解析:略
本题难度:简单
3、实验题 (14分 每空2分)化工原料红矾钠(重铬酸钠:Na2Cr2O7·2H2O)主要是以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下:
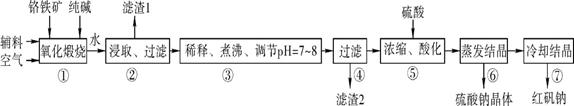
步骤①中主要反应的化学方程式如下:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2 8Na2CrO4+2Fe2O3+8CO2
(1) ①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是 。
(2) 杂质Al2O3在①中转化的化学反应方程式为 。
(3) 用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4) ⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式: 。
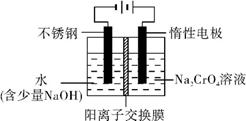
(5) 工业上还可用电解法制备重铬酸钠,其装置示意图如上。
阴极的电极反应式为 ;
阳极的电极反应式为 。
参考答案:(14分 每空2分) (1) 增大反应物的接触面积,加快反应速率
(2) Al2O3+Na2CO3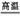 2NaAlO2+CO2↑ 2NaAlO2+CO2↑
(3) 水解吸热,煮沸促进水解平衡AlO2-+2H2O Al(OH)3+OH-、SiO32-+2H2O Al(OH)3+OH-、SiO32-+2H2O H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀 H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀
H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离
(4) 2CrO42-+2H+ Cr2O72-+H2O Cr2O72-+H2O
(5) 4H2O+4e- 4OH-+2H2↑(H+放电也可) 4OH-+2H2↑(H+放电也可)
4OH--4e- O2↑+2H2O O2↑+2H2O
本题解析:(1) 固体反应物在搅拌时,可以与氧气充分接触,增大接触面积,使反应速率加快;
(2)氧化铝与碳酸钠在高温条件下发生反应,生成偏铝酸钠和二氧化碳,化学方程式为Al2O3+Na2CO3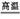 2NaAlO2+CO2↑ 2NaAlO2+CO2↑
(3)氧化煅烧再溶于水,所得溶液中有偏铝酸钠、硅酸钠、铬酸钠,其中AlO2-、SiO32-水解,水解吸热,煮沸促进水解平衡AlO2-+2H2O Al(OH)3+OH-、SiO32-+2H2O Al(OH)3+OH-、SiO32-+2H2O H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀;若溶液pH过低,则生成的氢氧化铝沉淀又溶解生成Al3+,杂质Al3+与Na2CrO4难以分离; H2SiO3+2OH-向右移动,生成氢氧化铝、硅酸沉淀;若溶液pH过低,则生成的氢氧化铝沉淀又溶解生成Al3+,杂质Al3+与Na2CrO4难以分离;
(4)酸性条件下CrO42-转化为Cr2O72-,该反应是可逆反应,离子方程式为2CrO42-+2H+ Cr2O72-+H2O; Cr2O72-+H2O;
(5)电解池中阴极是阳离子放电,根据离子的放电顺序,应是氢离子放电,所以电极反应式为4H2O+4e- 4OH-+2H2↑;或2H++2e-= H2↑;阳极是阴离子放电,所以是氢氧根离子放电,电极反应式为4OH--4e- 4OH-+2H2↑;或2H++2e-= H2↑;阳极是阴离子放电,所以是氢氧根离子放电,电极反应式为4OH--4e- O2↑+2H2O。 O2↑+2H2O。
考点:考查物质制备,涉及反应速率、化学方程式、离子方程式、电极反应式的判断与书写
本题难度:困难
4、选择题 有两只串联的电解池(惰性电极),甲池盛有CuSO4溶液,池盛有一定量某硝酸盐的稀溶液.电解时当甲池电极析出6.4gCu时,乙池电极析出2.4g金属,则乙池的溶质可能是( )
A.Ca(NO3)2
B.AgNO3
C.Al(NO3)3
D.Mg(NO3)2
参考答案:两只串联的电解池(惰性电极),甲池盛有CuSO4溶液,乙池盛有一定量某硝酸盐的稀溶液,电解时当甲池电极析出6.4gCu时,乙池电极析出2.4g金属,说明乙池中的金属元素在氢之后,
A.钙位于氢之前,电解硝酸钙溶液时,阴极上析出氢气,得不到金属单质,故A不符合;
B.银位于氢之后,电解硝酸银溶液时,阴极上析出银,故B符合;
C.铝位于氢之前,电解硝酸铝溶液时,阴极上析出氢气得不到金属单质,故C不符合;
D.镁位于氢之前,电解硝酸镁溶液时,阴极上析出氢气得不到金属单质,故D不符合;
故选B.
本题解析:
本题难度:简单
5、选择题 将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤.取滤液,用铂电极电解一段时间.则两极区析出的氧化产物与还原产物的质量比约为( )
A.35.5:108
B.108:35.5
C.8:1
D.1:2
参考答案:将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,发生反应:
K2SO4+Ba(NO3)2=BaSO4↓+2KNO3,AgNO3+NaCl=AgCl↓+NaNO3,搅拌、静置、过滤,滤液为KNO3和NaNO3溶液,
电解时发生:2H2O?电解?.?2H2↑+O2↑,氧化产物为O2,还原产物为H2,
两极区析出的氧化产物与还原产物的质量比约为32:2×2=8:1,
故选C.
本题解析:
本题难度:简单
|