微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )。
A.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是3∶4
C.现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl
D.从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),没有发生氧化还原反应
参考答案:C
本题解析:玻璃的主要成分是SiO2,高温下与C(碳)反应,A错误;反应中CO2作氧化剂,Na作还原剂,根据化合价升降值相等的原则,作为氧化剂的CO2与作为还原剂的Na的物质的量之比为1∶4,B错误;SiCl4水解生成HCl和硅酸,HCl与液氨反应生成NH4Cl,C正确;由化合态到游离态,一定发生氧化还原反应,D错误。
本题难度:一般
2、简答题 在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:
(1)图中C点表示当加入______molNaOH时,Al3+的存在形式是______(写化学式)
(2)图中线段OA:AB=______.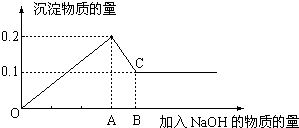
参考答案:根据图象可知,在滴加NaOH溶液到加入氢氧化钠为Amol时,沉淀量最大为0.2mol,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液.继续滴加氢氧化钠,但在加入(B-A)mol时,沉淀物质的量最小为0.1mol,是氢氧化镁沉淀,所以加入Amol氢氧化钠是沉淀中有氢氧化镁0.1mol、氢氧化铝0.1mol;此时溶液为氯化钠、偏铝酸钠溶液.
(1)根据氢氧根守恒可知,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol,C点氢氧化铝完全溶解,根据铝元素、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.1mol,所以溶解氢氧化铝加入的氢氧化钠为0.1mol.所以加入的氢氧化钠的物质的量为0.5mol+0.1mol=0.6mol;C点氢氧化铝完全溶解,铝元素在溶液中以AlO2-存在.
故答案为:0.6;AlO2-.
(2)OA表示滴加NaOH溶液是镁离子、铝离子完全沉淀是需要的氢氧化钠的物质的量,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol;AB表示溶解0.1mol氢氧化铝消耗的氢氧化钠的物质的量n(NaOH)=n[Al(OH)3]=0.1mol,所以线段OA:AB=0.5mol:0.1mol=5:1.
故答案为:5:1.
本题解析:
本题难度:一般
3、选择题 下列有关甲醛的化学用语表达错误的是
A.结构简式:HCHO?
B.最简式:CH2O
C.比例模型:?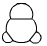 ?
?
D.电子式: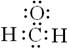
参考答案:D
本题解析:甲醛分子中含有碳氧双键,电子式应该是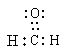 ,选项D不正确,其余选项都是正确的,答案选D。
,选项D不正确,其余选项都是正确的,答案选D。
点评:该题是高考中的常见考点和题型,属于基础性试题的考查,试题基础性强,主要是考查学生对甲醛结构熟悉了解程度,旨在考查学生灵活运用基础知识解决实际问题的能力。该题的关键是明确甲基的结构特点,然后灵活运用即可。
本题难度:一般
4、选择题 下列变化需加入还原剂才能完成的是(→代表转化)[? ]
A.NO3-→ NO
B.CO2→HCO3-
C.HS-→ S2-
D.MnO2→MnO4-
参考答案:A
本题解析:还原剂失去电子,元素的化合价升高。如果变化需加入还原剂才能完成,说明选项中微粒做氧化剂,元素的化合价降低,A中氮元素的化合价降低,正确;B中和C中元素的化合价没有变化,不是氧化还原反应。D中Mn元素的化合价的升高,需要加入氧化剂,答案选A。
点评:该题是中等难度的试题,也是高考中的常见考点,试题注重基础,侧重能力的培养和解题方法的指导,有助于培养学生的逻辑推理能力和灵活应变能力。另外该题还需要注意的是一些自身的氧化还原反应。
本题难度:一般
5、简答题 (1)分别取Wg钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是______;
(2)分别取0.1mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是______;
(3)若产生相同物质的量的氢气,所需钠、镁、铝的质量比为______;
(4)若产生相同体积(同温同压下)的氢气,所需钠、镁、铝三种金属的物质的量之比为______;
(5)若将0.2mol金属钠、铝、铁分别投入到10mL1mol/L的盐酸中,在标准状况下,产生氢气的体积大小顺序是______;
(6)把0.5mol钠投入到m1g水(过量)中得到a溶液,把0.5mol镁投入到m2g盐酸(过量)中得到b溶液,若m1=m2,则a、b质量的大小关系是______.
参考答案:涉及到的化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,
④Fe+2HCl=FeCl2+H2↑,
(1)设分别取Wg钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积分别为x、y、z,
2Na+2HCl=2NaCl+H2↑
46g 22.4L
Wg x
x=Wg×22.4L46g=W×22.446L,
Mg+2HCl=MgCl2+H2↑
24g22.4L
Wg y
y=W×22.424L,
2Al+6HCl=2AlCl3+3H2↑
54g 67.2L
Wg z
z=W×67.254L,
x:y:z=W×22.446L:W×22.424L:W×67.254L=123:112:19,故答案为:=123:112:19;
(2)由反应方程式可知,
分别取0.1mol钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比等于物质的量之比,为12:1:32=1:2:3,故答案为:1:2:3;
(3)设反应各生成1mol氢气,
则需m(Na)=46g,m(Mg)=24g,m(Al)=23×27g=18g,
产生相同物质的量的氢气,所需钠、镁、铝的质量比为46:24:18=23:12:9,故答案为:23:12:9;
(4)由反应方程式可知,
若产生相同体积(同温同压下)的氢气,所需钠、镁、铝三种金属的物质的量之比为2mol:1mol:23mol=6:3:2,故答案为:6:3:2;
(5)10mL1mol/L的盐酸的物质的量为0.01L×1mol/L=0.01mol,若将0.2mol金属钠、铝、铁分别投入到10mL1mol/L的盐酸中,可知三种金u属都过量,盐酸不足,完全反应,但金属钠能与水反应继续生成氢气,所以钠反应生成氢气最多,铝、铁反应生成氢气一样多,故答案为:Na>Al=Fe;
(6)利用差量法计算:
2Na+2H2O=2NaOH+H2↑△m
2mol 44g
0.5mol 11g
Mg+2HCl=MgCl2+H2↑△m
1mol 22g
0.5mol 11g
可知把0.5mol钠投入到m1g水(过量)中得到a溶液,把0.5mol镁投入到m2g盐酸(过量)中得到b溶液,溶液增加的质量相同,又m1=m2,则a、b质量的大小相等,
故答案为:=.
本题解析:
本题难度:简单