微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由锌.铁.铝.镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是( )
A.锌
B.铁
C.铝
D.镁
参考答案:产生11.2LH2需要锌32.5g,铁28g,铝9g,镁12g,根据平均值思想,混合物中的两种金属需要量应分别小于和大于10g,而小于混合物10g的只有铝,故一定有铝,
故选C.
本题解析:
本题难度:一般
2、简答题 环保部门对某硫酸厂排放废气中SO2的含量进行如下测定:取标准状况下含有SO2的废气1.00L,缓慢通过足量溴水(化学方程式为:Br2+SO2+2H2O═H2SO4+2HBr),在所得溶液中加入过量的BaCl2溶液,生成白色沉淀.将沉淀过滤、洗涤、干燥,称得其质量为0.233g.试计算:
(1)该废气样品中SO2的体积分数为______.
(2)若将用溴水吸收所得溶液稀释成100mL,则所得稀释液中H2SO4的物质的量浓度为______mol/L..
(3)该硫酸厂每天排放的SO2总量为32kg,若用石灰乳吸收该硫酸厂所排放的SO2,且生成CaSO3,则理论上每天需消耗Ca(OH)2的质量为______kg.
参考答案:(1)2.33g硫酸钡的物质的量为2.33g233g/mol=0.01mol,根据硫元素守恒,可知n(SO2)=n(H2SO4)=n(BaSO4)=0.01mol,故二氧化硫的体积为0.01mol×22.4L/mol=0.224L,二氧化硫的体积分数定义为0.224L1L×100%=22.4%,
故答案为:22.4%;
(2)由(1)计算可知,n(H2SO4)=n(BaSO4)=0.01mol,故溶液稀释成100mL,则所得稀释液中H2SO4的物质的量浓度为0.01mol0.1L=0.1mol/L,
故答案为:0.1;
(3)32kgSO2反应消耗Ca(OH)2的质量的为m,则:
? SO2+Ca(OH)2=CaSO3+H2O
? ?64? 74
? 32kg? m
故m=32kg×7464=37kg,
故答案为:37.
本题解析:
本题难度:一般
3、选择题 下列物质书写正确的是(?)
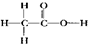
A.乙酸的结构式:
B.H2S
C.-CH3 
D.NH4I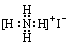
参考答案:A
本题解析:硫化氢是共价化合物,形成的化学键是极性键,电子式为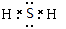 。甲基中碳原子的最外层电子是7个,电子式为
。甲基中碳原子的最外层电子是7个,电子式为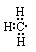 。碘化氨是离子化合物,电子式为
。碘化氨是离子化合物,电子式为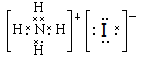 。
。
所以正确的答案是A。
本题难度:一般
4、选择题 已知在水溶液中氯气与碘可发生下列反应:I2+5Cl2+6H2O==2HIO3+10HCl。
下列关于该反应的说法中正确的是(?)
A.不是氧化还原反应,
B.是氧化还原反应,H2O是还原剂
C.是氧化还原反应,I2失去电子
D.是氧化还原反应,Cl2失去电子
参考答案:C
本题解析:略
本题难度:简单
5、简答题 中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O(没有配平).请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:______,鉴别这两种气体不能选用的试剂是______
a.BaCl2溶液?b.KMnO4溶液?c.品红溶液? d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是______.此时溶液中的离子按照浓度由大到小排列的顺序是______.
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是______?L(标况).将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因______.
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是______
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是______(简述操作过程及结论).
参考答案:(1)C、D两种气体均能使澄清石灰水变浑浊,能使澄清石灰水变浑浊的气体是二氧化碳和二氧化硫,所以C、D和二氧化碳和二氧化硫,A是碳,加热条件下,碳和浓硫酸反应生成二氧化碳、二氧化硫和水,反应方程式为:C+2H2SO4(浓)?△?.??CO2↑+2SO2↑+2H2O;
二氧化碳和二氧化硫相同的性质是都能使澄清石灰水变浑浊,不同点是二氧化硫具有漂白性和还原性,
a、二氧化硫和二氧化碳都不和氯化钡反应,所以现象相同,无法鉴别,故选;
b、二氧化硫能使酸性高锰酸钾褪色,二氧化碳不能使酸性高锰酸钾溶液褪色,所以能鉴别,故不选;
c、二氧化硫能使品红溶液褪色,二氧化碳不能使品红溶液褪色,所以能鉴别,故不选;
d、二氧化硫能和硝酸酸化的硝酸钡反应生成白色沉淀,二氧化碳不能和硝酸酸化的硝酸钡反应,所以能鉴别,故不选;
故选a;
氢氧化钠的物质的量=2mol/L×0.5L=1mol,二氧化碳的物质的量是0.8mol,1<n(NaOH)n(CO2)=54<2,所以氢氧化钠和二氧化碳反应生成碳酸钠和碳酸氢钠,氢氧化钠和二氧化碳恰好反应生成碳酸钠和碳酸氢钠,反应方程式为5NaOH+4CO2═Na2CO3+3NaHCO3+H2O;
5NaOH+4CO2═Na2CO3+3NaHCO3+H2O;
5mol 4mol? 1mol? 3mol
1mol 0.8mol 0.2mol 0.6mol
通过方程式知,生成0.2mol碳酸钠、0.6mol碳酸氢钠,钠离子不水解浓度最大,虽然碳酸钠和碳酸氢钠能水解,但盐在溶液中以电离为主,水解为次,所以碳酸氢根离子浓度大于碳酸根离子浓度,碳酸根离子和碳酸氢根离子水解导致氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,所以离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+);
故答案为:C+2H2SO4(浓)?△?.??CO2↑+2SO2↑+2H2O,a,5NaOH+4CO2═Na2CO3+3NaHCO3+H2O,c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+);
(2)无色气体C遇空气迅速变成经棕色,所以C是NO,A为红色金属单质铜,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,所以B是稀硝酸,根据氮原子守恒计算一氧化氮气体体积,设NO体积为X,
HNO3----NO,
1mol? 22.4L
2mol? x
x=44.8L
二氧化氮能自身转化为四氧化二氮,且二氧化氮和四氧化二氮之间存在化学平衡,该反应是放热反应,降低温度平衡向正反应方向移动,气体颜色变浅;
故答案为:44.8,2NO2(红棕色)?N2O4(无色);△H<0,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅;
(3)若A在水中的溶解度随温度的升高而降低是氢氧化钙,B为短周期非金属单质,D是漂白粉的成分之一,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,所以B是氯气,C能发生水解反应,所以C是次氯酸钙,D是氯化钙,次氯酸根离子水解方程式为:ClO-+H2O?HClO+OH-;
故答案为:ClO-+H2O?HClO+OH-;
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,五核10电子的阳离子是铵根离子,受热易分解,分解后生成两种极易溶于水的气体,则A是氯化铵,单核18电子的阴离子是氯离子,氯离子的检验方法是:取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-.
故答案为:取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-.
本题解析:
本题难度:一般