微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 铁和铁的化合物用途广泛.请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:______.
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______.
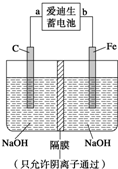
(2)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2
①爱迪生蓄电池的正极是______,该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______.
②高铁酸钠(Na2FeO4)是一种新型净水剂.用如图装置可以制取少量高铁酸钠.写出在用电解法制取高铁酸钠时,阳极的电极反应式______.
③你认为高铁酸钠作为一种新型净水剂的理由错误的是______.
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为______.
参考答案:(1)钢铁在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子O2+4e-+2H2O=4OH-,负极上铁失电子发生氧化反应,正极上发生的反应为O2+4e-+2H2O=4OH-,二价铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,氢氧化铁失去部分水生成铁锈,所以铁锈的成分是Fe2O3?xH2O,氧化铁和稀硫酸反应生成硫酸铁和水,离子方程式为:Fe2O3+6H+═2Fe3++3H2O,铁和铁离子能发生氧化还原反应生成亚铁离子2Fe3++Fe=3Fe2+,导致溶液中不存在铁离子,
故答案为:O2+4e-+2H2O=4OH-;Fe2O3+6H+═2Fe3++3H2O、2Fe3++Fe=3Fe2+;
(2)①放电时,镍元素的化合价由+4价变为+2价,所以NiO2作正极,充电时,铁电极上氢氧化亚铁得电子发生还原反应生成铁,
故答案为:NiO2;还原反应;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
③高铁酸钠具有强氧化性,所以能杀菌消毒;高铁酸钠能被还原生成铁离子,铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附悬浮杂质,所以能净水,故选ad;
(3)设Fe2+与Fe3+物质的量分别为x、y,根据铁原子、氧原子守恒得(x+y):(x+1.5y)=4:5,x=y,所以x:y=1:1,故答案为:1:1.
本题解析:
本题难度:一般
2、选择题 某原电池构造如右图所示。下列有关叙述正确的是(?)
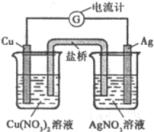
A.取出盐桥后,电流计的指针仍发生偏转
B.在外电路中,电子由银电极流向铜电极
C.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
D.盐桥中电子的移动是从右向左
参考答案:C
本题解析:A项取出盐桥后,停止反应,电流计的指针不偏转;B项在外电路中,电子由铜电极流向银电极;C项正确;D项盐桥中没有电子的移动,是离子的移动。
点评:原电池中电子的流向:由负极经导线流向正极,电流反之,属于简单题。
本题难度:一般
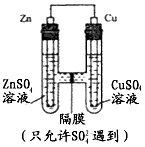
3、选择题 如图所示,下列叙述不正确的是
[? ]
A.该装置是原电池
B.锌为负极,发生氧化反应
C.硫酸根离子从左流向右
D.铜棒的质量会增重
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列关于原电池说法正确的是 (? )
A.原电池是一种直接把化学能转化为电能的装置,在此转化过程中无能量损耗
B.在Zn-Cu-H2SO4构成的原电池中,H+不断移向负极
C.钢铁在潮湿的环境中易被腐蚀与原电池有关
D.纯铁比生铁(含有少量杂质)与稀HCl反应快
参考答案:C
本题解析:原电池的能量转化率不可能是100%的,A不正确;原电池中阳离子向正极移动,B不正确;钢铁在潮湿的环境中易发生电化学腐蚀,C正确;生铁在和盐酸的反应中容易形成原电池,而加快反应速率,D不正确,答案选C。
点评:该题是中等难度的试题 ,也是高考中的常见题型。试题贴近高考,基础性强,旨在培养学生分析、归纳和总结问题的能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
5、填空题 钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: __________________________。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3·xH2O),反应的化学方程式是: ______________________________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是:____________________________。
(4)下列哪个装置可防止铁棒被腐蚀____________。

(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下
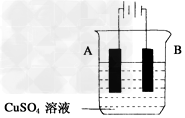
请回答:
①A电极对应的金属是_______(写元素名称),B电极的电极反应式是:____________。
②若电镀前铁、铜两极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12?g,则电镀时电路中通过的电子为____________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因____________________________________________。
参考答案:(1)3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(2)4Fe+3O2+2xH2O=2Fe2O3·xH2O
(3)2FeCl3+Fe=3FeCl2
(4)BD
(5)①铜;Cu2++2e-=Cu;②0.08;③铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
本题解析:
本题难度:一般