微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 A~J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已经略去)。已知A是一种高熔点的化合物,D是一种红棕色的固体,H的焰色反应呈黄色。

请回答下列问题:
(1)A物质的化学式为__________,H物质的化学式为__________。
(2)G J的化学方程式为___________。
(3)若D与盐酸恰好反应,改反应的离子方程式为_____________,常温下所得溶液的pH______(填大于、小于、等于)7,其原因是(用离子方程式表示) ________________。
(4)不纯的E在潮湿的空气中易发生电化学腐蚀,其负极发生的电极反应式是___________;正极发生的电极反应式是________________。
参考答案:(1)Al2O3 ;NaAlO2
(2)4Fe(OH)2+2H2O +O2 ==4Fe(OH)3
(3)Fe2O3+6H+==2Fe3++3H2O ;小于;Fe3++3H2O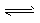 Fe(OH)3+3H+
Fe(OH)3+3H+
(4)2Fe-4e-==2Fe2+ ;2H2O +O2 +4e-==4OH-
本题解析:
本题难度:一般
2、填空题 (9分)A为单质,B、C、D、E为 与A含有相同元素的化合物,它们之间有如下转化关系:
与A含有相同元素的化合物,它们之间有如下转化关系:
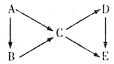
(1)若五种物质的焰色反应均为黄色,其中C、D、E的水溶液均显碱性,且等浓度时碱性C〉D〉E,B可做供氧剂。
①B的电子式__________,C中含有的化学键类型为__________ (填“离子键”、“极性键”或“非极性键”)。
②A转化成C的离子方程式为: ______ ______________
______________
(2)若常温下A、B、C、D均为气体,且D为红棕色气体。
①I)物质的化学式:__________.写出B—C的化学方程式为____________________
②将B和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是:__________
参考答案:

本题解析:略
本题难度:一般
3、填空题 (1)题每空1分,其余每空2分,共12分)物质A是化合物,B、C、D、K都是单质,反应②~⑤都是常见的工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
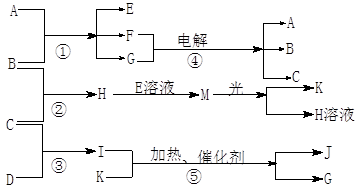
请填写下列空白:
(1)写出下列物质的化学式:B ??;? C?; D?;
K?;G?;J??。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M?。
②I溶于G ?。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为?
?。
参考答案:((1)题每空1分,其余每空2分,共12分)
(1)? B.Cl2?C.H2? D. N2? K. O2?G. H2O? J.NO(各1分)
(2) ①H+ +ClO-= HClO、②NH3+ H2O 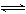 NH3、H2O
NH3、H2O NH4++OH- ?(各2分)
NH4++OH- ?(各2分)
(3)2HCl(g)=H2(g)+Cl2(g);△H=" +184.6" kJ·mol-1?(2分)
本题解析:根据反应①④可知,A是氢氧化钠,B是氯气,E是次氯酸钠,F是氯化钠,G是水。H是氯化氢,M是次氯酸,K是氧气。I是氨气,J是NO。
(2)盐酸的酸性强于次氯酸的,所以能制取次氯酸,方程式为H+ +ClO-= HClO;氨气溶于水生成氨水,方程式为NH3+ H2O 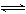 NH3、H2O
NH3、H2O NH4++OH-。
NH4++OH-。
(3)1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则1mol氢气在氯气中燃烧放出的热量是92.3 kJ×2=184.6 kJ,所以氯化氢分解的热化学方程式为2HCl(g)=H2(g)+Cl2(g);△H=" +184.6" kJ·mol-1。
本题难度:一般
4、填空题 A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略去)
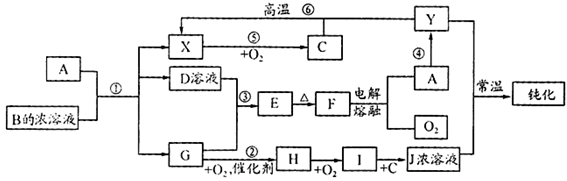
请填写下列空白:
(1)B的电子式为?;
(2)D固体可用于净水,请用相应的离子方程式及简单文字说明原因:?
?;
(3)反应⑥的化学方程式为?;
反应④在冶金工业上属于?(填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为?;
(5)反应②的化学方程式为?;
反应③的离子方程式为?;
(6)收集一试管H,将其倒置于水槽中,然后向试管中通入一定量的O2使试管内液面上升,最终剩余气体占试管容积的一半,则原有H与所通入O2的体积比为?。
参考答案:除(6)外, 每空2分)
每空2分)
(1)NH4Cl的电子式略
(2)AlCl3固体溶于水,电离产生的Al3+可水解Al3++3H2O Al(OH)3(胶体)+3H+,
Al(OH)3(胶体)+3H+,
生成的Al(OH)3胶体可吸附水中杂质,达到净水目的。(离子方程式书写正确给1分,提到Al(OH)3胶体可吸附给1分)
(3)3Fe+4H2O(g)  Fe3O4+4H2?热还原法(或铝热还原法)
Fe3O4+4H2?热还原法(或铝热还原法)
(4)将D的结晶水合物在HCl气流中加热?(提到HCl气体即给满分)
(5)
Al3++3NH3·H2O=Al(OH)3↓+3NH+ 4(或Al3++3NH3+3H2O=Al(OH)3↓+3NH+ 4)
(6)8:3或4:5?(各1分)
本题解析:略
本题难度:一般
5、填空题 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。

①A常温下为黄绿色的气体单质。
②B为一种常见变价金属单质,在冷的浓硫酸中会被钝化。
③C的水溶液是一种无氧酸,且C的组成中含有与A相同的元素。
请回答:(1) A的化学式为?,构成非金属单质A的元素的最高价氧化物的分子式为?,C的名称为?。
(2)A与水反应的化学方程式为?。
(3)A与E反应生成D的离子方程式为?。
(4)在E的水溶液中加入足量氢氧化钠溶液,观察到的现象为?。
参考答案:(1) Cl2,Cl2O7,氯化氢 (2) Cl2 + H2O =" HCl" + HClO?(3)2Fe2++ Cl2 =2Fe3++ 2 Cl-
(4)有白色絮状沉淀生成,然后迅速变成灰绿色,最后变成红褐色沉淀。
本题解析:根据①可知A是氯气。由②可知B是铁。所以D是氯化铁,因此E是氯化亚铁,则C是氯化氢。
本题难度:一般