微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,它
们互称为?(?)
A.同系物
B.同分异构体
C.同素异形体
D.同位素
参考答案:C
本题解析:C50、C70、C120、C540等都是C的不同单质,它们应互称为同素异形体,故应选C。
本题难度:一般
2、填空题 碳族元素是形成化合物种类最多的元素。
(1)碳原子2个2p电子的运动状态不相同的方面是_______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为_______ (选填序号)。
a.10? b.11? c.13? d.15
(2)如图是金刚石晶体的结构示意图。则关于金刚石的描述正确的是?(选填序号)。
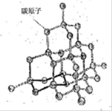
a.C-C键键角都为109°28’? b.最小的环由6个C原子构成
c.可溶于非极性溶剂? d.l mol金刚石含有4 mol C-C键
(3)以下比较错误的是________(选填序号)。
a.稳定性SiH4>CH4?b.沸点SiH4>CH4
c.熔点SiC>Si? d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一。
①配平以下制备NaBH4的化学方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为________。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为_________________________________________。
(6)若物质组成相似,可相互推算组成元素的相对原子质量。某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号)。
a.氧元素的相对原子质量
b.硅元素的相对原子质量
c.钠元素的相对原子质量
参考答案:(1)轨道(或电子云的伸展方向)(1分);bc(2分)
(2)a b(2分)
(3)a.(1分)
(4)①1,16,7,8—4,7(2分);② 0价的H(l分)
(5)CaCO3+CO2+H2O→Ca( HCO3)2(1分)? Ca(HCO3)2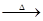 CaCO3↓+CO2↑+H2O(1分)
CaCO3↓+CO2↑+H2O(1分)
(6)b.(1分)
本题解析:(1)碳原子2个2p电子分别是x和y轨道上的,运动状态不相同的方面是轨道(或电子云的伸展方向);C5HxN分子中C、N原于最外层都达到8电子稳定结构,分子式可以有C5H10,C5H12,当分子中引入一个氮原子时,可以增加一个氢原子,即分子式可以为C5H11N,C5H13N,则x的值可能为 b.11和c.13。
(2)金刚石晶体是正四面体的空间网状结构,a.C-C键键角都为109°28’,正确; b.最小的环由6个C原子构成,正确;c.可溶于非极性溶剂 ,错误,难溶于任何溶剂中。d.l mol金刚石含有2 mol C-C键,错误;
(3)碳元素的非金属性强于硅,故a.稳定性SiH4>CH4?,错误;b.由于SiH4相对分子质量大于CH4,分子间作用力较大,故沸点SiH4>CH4,正确;c.两者都是原子晶体,熔点与共价键强弱有关,共价键越短键能越大,熔点越高,由于SiC中键长小于晶体Si中的键长,故熔点SiC>Si ,正确;d.键能C=C>C-C,正确;选a.
(4)NaBH4中B是+3价,H为-1价,化合价发生改变的元素是钠和硼,根据氧化还原反应原理和化合价升降相等,配平如下①1Na2B4O7+16Na+7SiO2+8H2→4NaBH4+7Na2SiO3.②化合价降低的元素就是被还原的元素为0价的H。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为CaCO3+CO2+H2O→Ca( HCO3)2,Ca(HCO3)2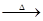 CaCO3↓+CO2↑+H2O。
CaCO3↓+CO2↑+H2O。
(6)锗酸钠和硅酸钠的组成完全相似,可以通过两者质量分数之比等于它们的相对原子质量之比,要求得锗的相对原子质量,必须要知道 b.硅元素的相对原子质量。
本题难度:一般
3、选择题 A、B分别是M元素的碳酸盐和碳酸氢盐,将一定量A、B的混合物与足量盐酸反应,消耗HCl与生成CO2的物质的量之比为3∶2。已知M可能是ⅠA族或ⅡA族元素,则混合物中A、B的物质的量之比可能是(?)
A.3∶1? B.2∶1?C.1∶2? D.1∶1
参考答案:BD
本题解析:若M为ⅠA族元素,则有
M2CO3+2HCl 2NaCl+H2O+CO2↑
2NaCl+H2O+CO2↑
X? 2x? x
MHCO3+HCl MCl+H2O+CO2↑
MCl+H2O+CO2↑
Y? y? y
则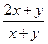 =
=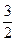
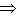
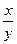 =
=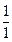
若M为ⅡA族元素,则有
MCO3+2HCl MCl2+H2O+CO2↑
MCl2+H2O+CO2↑
X? 2x? x
M(HCO3)2+2HCl MCl2+2H2O+2CO2↑
MCl2+2H2O+2CO2↑
Y? 2y? y
则 =
=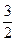
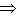
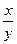 =
=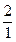
本题难度:简单
4、选择题 将适量的CO2分别通过①CaCl2?②Na2SiO3?③Ca(ClO)2?④Na2CO3饱和溶液,溶液中必定有白色沉淀析出的是(?)
A.①②③④
B.②③
C.②③④
D.①②③
参考答案:C
本题解析:②中沉淀为H2SiO3,③中为CaCO3,④中为NaHCO3。
本题难度:简单
5、填空题 在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4? SiCl4+2H2=Si(纯)+4HCl。若在25℃101KPa条件下反应生成HCl气体49L(注:25℃101KPa条件下气体摩尔体积为24.5L/mol)则:
(1)反应生成HCl气体的质量为__________,转移电子的个数为_____________。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为?。
(3)“从沙滩到用户”涉及到多个反应,其中制取粗硅的反应方程式为?,纯净的石英砂与烧碱反应可以制得水玻璃,反应的离子方程式为?。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O 13%,CaO 11.7%,SiO2 75.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是?t(保留两位小数)。
参考答案:(1)73g? 4NA
(2)12mol/L
(3)SiO2+2C Si(粗)+2CO↑? SiO2+2OH-=SiO32-+H2O
Si(粗)+2CO↑? SiO2+2OH-=SiO32-+H2O
(4)12.65
本题解析:(1)25℃101KPa条件下气体摩尔体积为24.5L/mol,49L HCl气体的物质的量为2mol,其质量为2mol×36.5g/mol=73g,两个反应共转移电子个数为4NA。
(2)溶质质量为73g,水的质量为127g,所以溶液体积为200g/1.20g/mL=1/6L,则盐酸的物质的量浓度是2mol/1/6L=12mol/L。
(3)制取粗硅是用碳还原二氧化硅,其方程式为SiO2+2C Si(粗)+2CO↑,石英的主要成分是SiO2,与烧碱反应制取水玻璃,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
Si(粗)+2CO↑,石英的主要成分是SiO2,与烧碱反应制取水玻璃,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
(4)10t这种玻璃中含Na2O1.3t,CaO1.17t,SiO27.53t,由CaCO3~CaO可计算出所需CaCO3的质量,同理可算出纯碱、石英的质量,约为12.65t。
本题难度:一般