微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理完成下列各小题:
(1)取A与足量的盐酸反应:
①若n(A)为定值,生成气体的量即为定值,则A的组成可能有________种。
②若m(A)为定值,生成气体的量为定值,则A的可能组成是(填写化学式):________、________;________、________;________、________。(可以不填满)
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0 g,则混合固体A的总物质的量是多少?
参考答案:
(1)①6?②NaHCO3、MgCO3?KHCO3、CaCO3
(2)0.200mol
本题解析:
(1)①题中所给物质为1 mol,均生成1 mol CO2气体,所以4种物质两两组合均符合题意。
②摩尔质量相等时符合题意,NaHCO3、MgCO3的摩尔质量均为84 g·mol-1,KHCO3、CaCO3的摩尔质量均为100 g·mol-1。
(2)两次生成的CO2:n(CO2)=n(CaCO3)=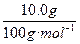 ="0.100" mol,实际上先将A加热,剩余固体再与足量的盐酸反应,A中的C元素均转化成CO2,根据C元素守恒有:n(A)="0.100" mol×2="0.200" mol。
="0.100" mol,实际上先将A加热,剩余固体再与足量的盐酸反应,A中的C元素均转化成CO2,根据C元素守恒有:n(A)="0.100" mol×2="0.200" mol。
本题难度:简单
2、选择题


A.阴离子化学式为:Si6O1812—
B.绿柱石可用氧化物形式表示为:3BeO·Al2O3·6SiO2
C.绿柱石可表示为Be3Al2[Si3O12]
D.绿柱石可溶于强碱和氢氟酸
参考答案:C
本题解析:本题考查硅酸盐的结构、性质和表示方法,较难题。解题关键是由阴离子部分的结构图解读出其原子组成和所带电荷数。阴离子里共有6个SiO44—单元,但其中有6个氧原子是共用的,故氧原子总数为4×6–6=18个,根据O和Si的化合价可计算出该阴离子带有12个负电荷,故其化学式为Si6O1812—,A正确;再根据电荷守恒(或化合价代数和为零)可推出该硅酸盐的化学式为Be3Al2[Si6O18],也可用氧化物的形式表示为3BeO·Al2O3·6SiO2,故B对C错;硅酸盐一般可与强碱反应,也能与HF反应,D也正确。
本题难度:一般
3、选择题 下列叙述正确的是
A.CuSO4·5H2O是一种混合物
B.常温下,pH=1的水溶液中Na+、NO3—、HCO3—、Fe2+可以大量共存
C.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2
D.C(石墨,s)=C(金刚石,s) ;△H>0,所以石墨比金刚石稳定
参考答案:D
本题解析:A 错误,硫酸铜晶体是纯净物
B 错误,在酸性条件下,硝酸根离子和二价铁离子不能共存
C 错误,逐滴加入等物质的量的稀盐酸,会生成氯化钠和碳酸氢钠,不生成二氧化碳
D 正确。能量越低越稳定。
本题难度:简单
4、选择题 将氧气通过灼热的炭层,得到一氧化碳和二氧化碳的混合气体,经测定,在混合气体中氧的质量分数为64%。试分析该混合气体中一氧化碳与二氧化碳的体积比为(?)
A.1∶2
B.2∶1
C.1∶1
D.1∶3
参考答案:B
本题解析:该混合气体中,两元素的原子个数比为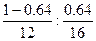 =3∶4,则该混合气体的平均组成为C3O4
=3∶4,则该混合气体的平均组成为C3O4 2CO+CO2。
2CO+CO2。
本题难度:简单
5、选择题 光导纤维被广泛用于光缆通讯,其主要成分是
A.CuO
B.Fe2O3
C.Al2O3
D.SiO2
参考答案:D
本题解析:光导纤维的主要成分是SiO2
本题难度:一般