微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
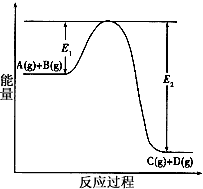
(1)该反应是___________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),原因是
_______________________________________。
(3)反应体系中加入催化剂对反应热是否有影响?_________,原因是___________________________
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”)。
参考答案:(1)放热反应
(2)减小;因为正反应放热,升温平衡逆向移动,所以A的转化率减小
(3)无;加催化剂平衡不移动
(4)减小;减小
本题解析:
本题难度:一般
2、填空题 (11分)已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素。
⑴ W在周期表中的位置:?。
⑵在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
3X2 (g)? + Y2(g)  2YX3(g)?△H?反应各物质的量浓度随时间变化如下:
2YX3(g)?△H?反应各物质的量浓度随时间变化如下:
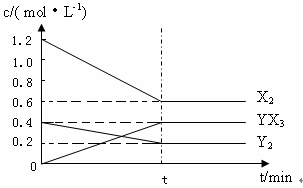
①此反应的平衡常数表达式为??(用化学式表示) ,? K=?。
②若升高温度平衡常数K减小,则△H?0(填>,<)。
⑶A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为?。
⑷B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是?。
⑸A2和B1反应生成B2,则0.2mol/LA2和0.1mol/L B1等体积混合后溶液中离子浓度大小关系为?。
参考答案:(1)第三周期,IA(2分)
(2)①K= C(NH3)2/[C(H2)3C(N2)] (1分) 100/27 (mol/L)-2? (2分) ②<(1分)
(3)NaOH电子式(1分)
(4)硝酸电离的氢离子抑制了水的电离,铵根离子的存在促进了水的电离
(2分)
(5)C(NH4+)> C(NO3-)>C(OH-) >C(H+)(2分)
本题解析:根据元素原子结构特点可推出各元素为X为氢,Y为氮,Z为氧,W为
钠。从而通过分析思考进行解答。
本题难度:一般
3、选择题 一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是(? )
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是(? )
A.若升高温度,X的体积分数增大,则正反应为吸热反
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.以X浓度变化表示的反应速率为0.001 mol/(L·s)
参考答案:D
本题解析:反应2X(g)+Y(g) Z(g),升高温度,X的体积分数增大,说明反应向逆反应方向进行,故该反应的正反应为放热反应,所以A错误;将容器体积变为20 L,相当于压强变下,所以平衡向左移动,故Z的平衡浓度小于原来的1/2,故B错误;若增大压强,平衡向正反应方向进行,则物质Y的转化率增大,故C错误;以X浓度变化表示的反应速率为v(X)=2v(Z)="2" ×0.3/10/60 mol/(L·s)=" 0.001" mol/(L·s),故D正确,为本题的答案。
Z(g),升高温度,X的体积分数增大,说明反应向逆反应方向进行,故该反应的正反应为放热反应,所以A错误;将容器体积变为20 L,相当于压强变下,所以平衡向左移动,故Z的平衡浓度小于原来的1/2,故B错误;若增大压强,平衡向正反应方向进行,则物质Y的转化率增大,故C错误;以X浓度变化表示的反应速率为v(X)=2v(Z)="2" ×0.3/10/60 mol/(L·s)=" 0.001" mol/(L·s),故D正确,为本题的答案。
点评:本题考查了化学平衡,化学反应速率,这些考点都是高考考查的重点和难点,本题难度中等。
本题难度:一般
4、填空题 脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为______________________________。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式为________________________(忽略氧的氧化还原);该方法的优点是________________________________。
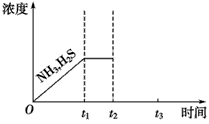
(3)一定温度下,1 mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p氨气×p硫化氢=aPa2,则容器中的总压为________Pa;
②下图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
参考答案:(1)2Fe3++H2S==S↓+2Fe2++2H+
(2)NaS+2H2O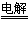 S↓+H2↑+2NaOH;副产物是氢气,生成的NaOH可循环利用
S↓+H2↑+2NaOH;副产物是氢气,生成的NaOH可循环利用
(3)①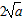 ②
②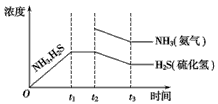
本题解析:
本题难度:一般
5、填空题 将盛有NO2N2O4混合气体的平衡球一端放入热水中,另一端放入冷水中,则放入热水的一端颜色______另一端颜色______.
参考答案:平衡2NO2(g)?N2O4(g)△H<0,升高温度向吸热方向移动,即逆反应方向移动,NO2浓度增大,颜色加深,所以放入热水的一端颜色变深,另一端颜色变浅;
故答案为:变深;变浅.
本题解析:
本题难度:一般