微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有关下列表述
①16O2与18O2互为同位素
②C2H4与C6H12互为同系物
③淀粉与纤维素互为同分异构体
④白磷与红磷是同素异形体,它们之间的转化是物理变化
⑤碳与硅是同主族元素,故CO2与SiO2结构相似,性质相似
⑥PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
A.都不正确
B.只有①③⑤正确
C.只有②④⑤正确
D.只有①②⑥正确
参考答案:A
本题解析:
本题较易,但学生应该熟知各种定义。
同位素:是在原子基础上的定义,而非单质。所以①不对。
②中学生容易忽略有机物中的同分异构:C6H12可以是烯烃,也可以是环烷烃。
③中学生容易忽略同分异构体判断的前提:应是两种纯净物之间的关系,而淀粉与纤维素都是混合物。
④中学生应正确理解化学变化:分子发生变化,可以是分子的组成元素发生了变化;还可以是元素组成不变但原子间化学键发生变化。
⑤中学生首先应明确不同的晶体类型CO2为分子晶体,SiO2为原子晶体。
⑥中BCl3中B原子不满足8电子稳定结构。
本题难度:简单
2、简答题 (1)已知拆开1mol?H-H键、1mol?I-I键、1mol?H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成1mol?HI需要?(填“放出”或“吸收”)?kJ的热量.氢气、碘单质和碘化氢三种分子最稳定的是?.
(2)下列五种物质中①Ne?②H2O?③NH3?④KOH?⑤Na2O,只存在共价键的是?,只存在离子键的是?,既存在共价键又存在离子键的是?,不存在化学键的是?.(填写序号)
(3)按要求填空:
①推测Si、N?间氢化物的稳定性;?>?(填化学式)?
②C:?周期?族;
③3416S2-微粒中的质子数是?,中子数是?,核外电子数是?.
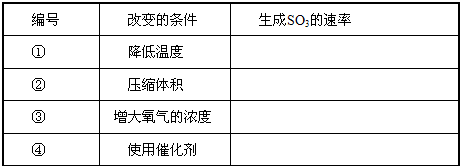
(4)对于反应2S02+02

2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
参考答案:(1)由氢气和碘单质反应生成1mol?HI,则需断裂0.5molH-H和0.5molI-I键,
吸收的能量为:0.5×436kJ+0.5×151kJ=293.5kJ,
生成1mol?HI分出的能量为:299kJ,
所以该反应放热,放出的能量为:299kJ-293.5kJ=5.5kJ,三种物质中键能最大的是H2,则最稳定的是H2,
故答案为:放出;5.5;H2;
(2)共价键是有非金属原子之间通过共用电子对形成的化学键,离子键是离子之间的静电作用,存在离子化合物中,
①Ne为单原子分子,不存在化学键;?②H2O、③NH3为共价化合物,只存在共价键,
?④KOH?为离子化合物,既含有离子键,又含有共价键,⑤Na2O为离子化合物,只含有离子键,
故答案为:②③;⑤;④;①;
(3)①N元素的非金属性大于Si元素,非金属性越强,对应的氢化物越稳定,
故答案为:NH3,SiH4;
?②C的原子序数为6,核外有2个电子层,最外层电子数为4,位于周期表第二周期第IVA族,故答案为:二,IVA;?
③3416S2-微粒中,质子数为16,中子数为34-16=18,电子数为16+2=18,
故答案为:16,18,18;
(4)在可逆反应中,增大压强、升高温度,增大反应物的浓度以及使用催化剂都能增大反应速率,反之,反应速率减小,
故答案为:
?编号?改变的条件?生成S03的速率?①?降低温度?减小?②?压缩体积?增大?③?增大氧气的浓度?增大?④?使用催化剂?增大
本题解析:
本题难度:一般
3、选择题 下列物质中含有离子键的是(?)
A.H2O
B.HCl
C.NaCl
D.H2
参考答案:C
本题解析:除了NaCl,其他几个选项中均只有共价键?存在。
本题难度:简单
4、选择题 关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰和水中都存在氢键
C.DNA双螺旋的两个螺旋链不是通过氢键相互结合的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
参考答案:B
本题解析:水分子内不存在氢键,A不正确;DNA双螺旋的两个螺旋链是通过氢键相互结合的,C不正确;水分子的稳定性和化学键有关系,与氢键无关,D不正确,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点之一。试题主要是考查学生对氢键概念的了解掌握程度,以及灵活运用氢键解决实际问题的能力,难度不大。该题有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:一般
5、填空题 氮可以形成多种离子,如N3-、NH2-、NH2、N3、NH4+、N2H5+、N2H62+等,已知N2H5+与N2H62+是由中 性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质。
(1)写出N2H62+与足量的NaOH溶液反应的离子方程式:___。
(2)N2O、CO2、CNO -都与N3-互为等电子体,它们具有相似的结构,则请写出N3-的电子式为___。
(3)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种阳离子“N5n+”,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N三N键。请写出 “N5n+”带具体电荷的电子式和结构式:___、____。
(4)请你预计科学家即将合成的N8属于___(填“单质”、“共价化合物”或“离子化合物”);其电子式为___,请写出其含有的所有化学键的类型:___;预计它在常温下是___体,熔沸点__(填“低”、“较高”或“高”),熔融状态下___(填“会”或“不会”)导电。
参考答案:(1)N2H62+ +2OH+=N2H4 +2H2O
(2)
(3)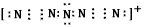 ;
;
(4)单质; ;离子键、非极性共价键、配位键;固;较高;会
;离子键、非极性共价键、配位键;固;较高;会
本题解析:
本题难度:一般