微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol?L-1,对此反应速率的表示,正确的是( )
A.用A表示的反应速率为0.4?mol?L-1?min-1
B.分别用B、C、D表示的反应速率其比值为1:2:3
C.在2?min末的反应速率,用B表示是0.3?mol?L-1?min-1
D.在这2?min内用B和C表示的反应速率都是逐渐减小的
参考答案:D
本题解析:
本题难度:简单
2、选择题 化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是 ( ?)
CuS(s)+Mn2+(aq),下列说法错误的是 ( ?)
A.相同条件下,MnS的Ksp比CuS的Ksp大
B.该反应的平衡常数K=
C.该反应达到平衡时c(Mn2+)=c(Cu2+)
D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
参考答案:C
本题解析:A、沉淀容易向更难溶的方向转化,因此根据反应式Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)可知,相同条件下,MnS的Ksp比CuS的Ksp大,A正确;B、化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,但固体不能出现在平衡常数的表达式中,所以该反应的平衡常数K=
CuS(s)+Mn2+(aq)可知,相同条件下,MnS的Ksp比CuS的Ksp大,A正确;B、化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,但固体不能出现在平衡常数的表达式中,所以该反应的平衡常数K= ,B正确;C、平衡时浓度不再发生变化,但c(Mn2+)与c(Cu2+)比亚迪相等,C不正确;D、往平衡体系中加入少量CuSO4固体后,铜离子浓度增大,平衡向正反应方向进行,则c(Mn2+)变大,D正确,答案选C。
,B正确;C、平衡时浓度不再发生变化,但c(Mn2+)与c(Cu2+)比亚迪相等,C不正确;D、往平衡体系中加入少量CuSO4固体后,铜离子浓度增大,平衡向正反应方向进行,则c(Mn2+)变大,D正确,答案选C。
本题难度:简单
3、填空题 (15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:

(1)加酸可以使CrO42-转化为Cr2O72-:?2CrO42- + 2H+ ?Cr2O72- + H2O
?Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol?L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K=?。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为?。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol?L-1,溶液的pH应升高到?。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的?极。
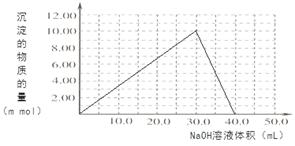
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为?。往100.00mL 0.1000 mol?L-1CrCl3溶液滴加1.000mol?L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图:
参考答案:(1).1.0×105(2)3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O? 5
(3) 正;4) 2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O。
 。
。
本题解析:(1)化学平衡常数 。(2)在酸性溶液中通SO2将Cr2O72-还原为Cr3+,根据电子守恒及电荷守恒、原子守恒可得反应的离子方程式为3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O;常温下Ksp[Cr(OH)3] =10-32, c(Cr3+)=10-5mol/L,c3(OH-)=10-32÷10-5=10-27.所以c(OH-)=10-9mol/L.则c(H+)=Kw÷c(OH-)=10-5mol/L,因此pH=5。(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片若要失去电子变为Fe2+,则铁片要与电源的正极连接。Cr(OH)3与稀硫酸反应化学方程式为2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O。n(Cr3+)=0.1L×0.100mol/L=0.01mol.向该溶液中加入NaOH首先发生反应:Cr3++3OH-=Cr(OH)3↓当n(NaOH)= 0.03mol,即NaOH的体积为30ml时沉淀达到最大值,再加入NaOH溶液,发生反应:Cr(OH)3+ OH-= CrO2-+ 2H2O,此时又消耗NaOH的物质的量为0.01mol,即再消耗10ml.,达到40ml时,沉淀完全溶解。之后再滴加NaOH溶液,也不会发生反应。生成沉淀的物质的量与加入NaOH溶液体积的关系图为
。(2)在酸性溶液中通SO2将Cr2O72-还原为Cr3+,根据电子守恒及电荷守恒、原子守恒可得反应的离子方程式为3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O;常温下Ksp[Cr(OH)3] =10-32, c(Cr3+)=10-5mol/L,c3(OH-)=10-32÷10-5=10-27.所以c(OH-)=10-9mol/L.则c(H+)=Kw÷c(OH-)=10-5mol/L,因此pH=5。(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片若要失去电子变为Fe2+,则铁片要与电源的正极连接。Cr(OH)3与稀硫酸反应化学方程式为2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O。n(Cr3+)=0.1L×0.100mol/L=0.01mol.向该溶液中加入NaOH首先发生反应:Cr3++3OH-=Cr(OH)3↓当n(NaOH)= 0.03mol,即NaOH的体积为30ml时沉淀达到最大值,再加入NaOH溶液,发生反应:Cr(OH)3+ OH-= CrO2-+ 2H2O,此时又消耗NaOH的物质的量为0.01mol,即再消耗10ml.,达到40ml时,沉淀完全溶解。之后再滴加NaOH溶液,也不会发生反应。生成沉淀的物质的量与加入NaOH溶液体积的关系图为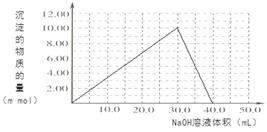 。
。
本题难度:一般
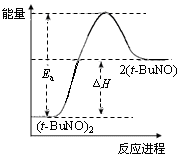
4、选择题 物质(t-BuNO)2在正庚烷或CCl4中均可以发生反应:(t-BuNO)2 2(t-BuNO)。在20℃时,向1 L正庚烷中加入(t-BuNO)2 0.50 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向1 L正庚烷中加入(t-BuNO)2 0.50 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1 L)。下列说法正确的是
A.反应在前10 min内的平均速率为ν(t-BuNO)=0.0325mol·L-1·min-1
B.保持其他条件不变,若此时再向溶液中加入0.50 mol (t-BuNO)2,重新达平衡时(t-BuNO)2的百分含量减小
C.保持其他条件不变,若该反应在CCl4中进行,其平衡常数为1.9,则(t-BuNO)2的平衡转化率小于65%
D.保持其他条件不变,升高温度, (t-BuNO)2的平衡转化率大于65%,则其能量关系可用下图表示