微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构如图所示:
下列关于这些晶体结构和性质的叙述不正确的是

[? ]
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键
参考答案:B
本题解析:
本题难度:简单
2、计算题 (8分)某离子晶体的晶胞结构如图所示。
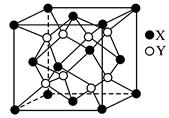
试求:
(1)晶体中每一个Y同时吸引着________________个X,每个X同时吸引着_____________个Y,该晶体的化学式是________________________________________________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为________________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ g·cm-3,阿伏加德罗常数为Na,则晶体中两个距离最近的X中心间的距离为________________cm。
参考答案:(1)4? 8? XY2或(Y2X)? (2)12? (3)109°28′
(4)
本题解析:(1)此结构虽不符合晶胞“无隙并置”,但仍可用此立方结构单元计算晶体组成。此立方单元中只有1个Y,且每个Y同时吸引4个X,而X处于顶点上为8个立方单元所共有,即每个X同时吸引8个Y。在每个该立方单元中含X ×4=
×4= (个),含Y? 1个,则化学式为XY2或Y2X。
(个),含Y? 1个,则化学式为XY2或Y2X。
(2)在一个立方单元中,每个X与它的距离最接近的X有三个,则每个X周围有3× =12(个)(每个面为两个立方单元共有)。
=12(个)(每个面为两个立方单元共有)。
(3)在此立方单元中,Y与4个X形成正四面体结构,故键角为109°28′。
(4)因为一个立方单元中只含 个XY2,则有
个XY2,则有 =ρ·V·NA,V=
=ρ·V·NA,V= ,而V=l+3(设边长为l),则l+3=
,而V=l+3(设边长为l),则l+3= ,l=
,l= ,设X与X间的距离为s,
,设X与X间的距离为s,
s= ·
·
本题难度:一般
3、选择题 下列大小关系正确的是?(?)
A.熔点:NaI>NaBr
B.硬度:MgO>CaO
C.晶格能:NaCl<NaBr
D.熔沸点:CO2>NaCl
参考答案:B
本题解析:选项ABC都是离子晶体,形成离子晶体的离子键越强,熔沸点的越高,硬度越大。形成离子键的离子半径越小,电荷数越多,离子键越强,所以选项AC不正确,B正确。D中CO2是分子晶体,熔沸点低于离子晶体氯化钠的,答案选B。
本题难度:一般
4、选择题 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和Si
B.CO2和H2O
C.NaCl和HCl
D.CCl4和KCl
参考答案:B
本题解析:
试卷分析:A选项SO2是分子晶体而Si是原子晶体。C选项氯化钠存在的是离子键而氯化氢存在的是极性共价键。一般情况下离子键是含有金属元素或铵根离子,但也有特殊的例如氯化铝,而共价键主要存在于非金属元素之间。如果是同种的非金属元素之间形成的是非极性键,不同种的非金属元素之间形成的是极性共价键。所以C选项是错误的。D选项四氯化碳存在的是极性共价键而氯化钾存在的是离子键故答案选B,二氧化碳和水中都只存在极性共价键。
本题难度:一般
5、选择题
A.CH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.石墨>金刚石>SiO2>MgO
参考答案:D
本题解析:晶体熔点的高低取决于构成该晶体结构的粒子间结合能力的大小。
A项物质均为结构相似的分子晶体,其熔点取决于分子间作用力的大小。一般来说,结构相似的分子晶体,相对分子质量越大,分子间作用力也越大,故A项各物质熔点应为逐渐升高的顺序。
B项物质均为离子晶体,离子晶体熔点高低取决于离子键键能的大小,离子的半径越小,电荷越多,离子键的键能就越大,故B项各物质熔点也应为升高顺序。
C项物质均为同主族的金属晶体,其熔点高低取决于金属键的强弱,而金属键能与金属原子半径成反比,与价电子数成正比;碱金属原子半径依Li一Cs的顺序增大,价电子数相同,故熔点应是Li最高,Cs最低。
D:一般原子晶体的熔点高于离子晶体。原子晶体的熔点取决于共价键的键能,而键能则与键长成反比,即:键长越短则键能越大;石墨中C—C键的键长比金刚石中C—C键的键长更短些,所以石墨熔点比金刚石略高,金刚石熔点又比二氧化硅高。
本题难度:一般