微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 (二选一)【物质结构】
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为____________________。
(2)A的最高价氧化物对应的水化物分子中其中心原子采取_________杂化。
(3)已知A、C形成的化合物分子甲与B的单质分子结构相似,1mol甲中含有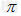 键的数目为__________。
键的数目为__________。
(4)D的核外电子排布式是_________________,它的高价离子与B的简单氢化物形成的配离子的化学式为_______________。
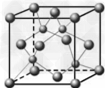
(5)D的氢化物的晶体结构如图所示,写出此氢化物在氯气中燃烧的化学方程式_________________________。
参考答案:(1)C<O<N
(2)sp2
(3)2NA(或1.204×1024)
(4)1s22s22p63s23p63d104s1(或[Ar]3d104s1);[Cu(NH3)4]2+
(5)2CuH+3Cl2==2CuCl2+2HCl
本题解析:
本题难度:一般
2、选择题 X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素原子的最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2、 ②X2YZ3、③X2YZ2、④X2Y2Z4、⑤X3YZ4、⑥XYZ3,其中可能存在对应分子的是
[? ]
A.②
B.②④
C.②⑤⑥
D.①②③④
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列各组大小顺序不正确的是( )
A.粒子半径:S2->Cl->Na+>Mg2+
B.热稳定性:SiH4<PH3<H2S<HCl
C.熔点:SiO2>NaCl>碘>干冰
D.还原性:HI<HBr<HCl<HF
参考答案:A.S2-和Cl-具有相同的核外电子排布,都有3个电子层,原子核外电子排布相等的离子,核电核数越大,离子半径越小,则有S2->Cl-,Na+和Mg2+具有相同的核外电子排布,都有2个电子层,离子半径Na+>Mg2+,故有S2->Cl->Na+>Mg2+,故A正确;
B.非金属性:Cl>S>P>Si,元素的非金属性越强,对应的氢化物越稳定,则有热稳定性:SiH4<PH3<H2S<HCl,故B正确;
C.SiO2为原子晶体,NaCl为离子晶体,碘和二氧化碳为分子晶体,碘在常温下为固态,二氧化碳为气态,碘的熔点大于干冰,不同晶体的熔沸点高低顺序为:原子晶体>离子晶体>分子晶体,则熔点:SiO2>NaCl>碘>干冰,故C正确;
D.非金属性:F>Cl>Br>I,元素的非金属性越强,对应的氢化物的还原性越弱,则有还原性:HI>HBr>HCl>HF,故D错误.
故选D.
本题解析:
本题难度:一般
4、选择题 关于元素周期表,下列叙述中不正确的是
[? ]
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在非金属元素区域可以寻找制备新型农药材料的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列叙述能说明氯元素原子得电子能力比硫元素强的是( )
①HCl的溶解度比H2S大?②HCl的酸性比H2S强?③HCl的稳定性比H2S强
④HCl的还原性比H2S强?⑤HClO的酸性比H2SO4弱
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS?⑦Cl2能与H2S反应生成S
⑧在周期表中Cl处于S同周期的右侧?⑨还原性:Cl-<S2-.
A.③④⑤⑦⑧⑨
B.③⑥⑦⑧
C.③⑥⑦⑧⑨
D.①②③④⑤⑥⑦⑧⑨
参考答案:①HCl的溶解度比H2S大,溶解度是物理性质,不能比较非金属性强弱,故①错误;
②氢化物酸性不能比较非金属性强弱,如HF是弱酸、HCl是强酸,但非金属性F>Cl,故②错误;
③HCl的稳定性比H2S强,说明Cl元素的非金属性强,故③正确;
④HCl的还原性比H2S弱,故④错误;
⑤HClO不是最高价含氧酸,不能比较与H2SO4的酸性强弱比较Cl、S元素的非金属性,故⑤错误;
⑥Cl2与铁反应生成FeCl3,Fe为+3,而S与铁反应生成FeS,Fe为+2价,故Cl元素的非金属性强,故⑥正确;
⑦Cl2能与H2S反应生成S,说明氯气的氧化性强,则Cl元素的非金属性强,故⑦正确;
⑧同周期自左而右非金属性增强,在周期表中Cl处于S同周期的右侧,则Cl元素的非金属性强,故⑧正确;
⑨阴离子的还原性越强,元素的非金属性越弱,还原性:Cl-<S2-,则Cl元素的非金属性强,故⑨正确;
故选C.
本题解析:
本题难度:简单