微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.金属钠应保存在水里以隔绝空气
B.常温下铁能与水蒸气反应生成氢气
C.可以用铁制品或铝制品容器盛放浓H2SO4
D.铝较活泼,所以铝制品在空气中不能稳定存在
参考答案:C
本题解析:钠的密度小于水,一般保存在煤油中;铁能与水蒸气在高温下才能反应;铝较活泼,常温下既可以表面生成一层致密的氧化膜,阻止了它继续氧化,所以可稳定存在,不易生锈。
本题难度:简单
2、选择题 对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论。其中预测物质的性质在整个程序中起着重要的作用。K与Na在性质上具有很大的相似性,但K比Na的活泼性强。下面是根据Na的性质对K的性质的预测,其中正确的是(?)
A.因为K的活泼性强,比钠更容易与空气中的氧气和水蒸气反应,所以钾也应该保存在煤油中
B.K在空气中可以被空气中的氧气氧化,且产物是K2O
C.K与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D.K可以与水剧烈反应,生成氧气
参考答案:A
本题解析:K的活泼性比钠的强,K更容易与空气中的氧气和水蒸气反应,所以钾也应该保存在煤油中。K在空气中可以被空气中的氧气氧化,但产物不是K2O,而是复杂的氧化物。K与水比Na与水的反应更剧烈,产物是氢气而不是氧气。
本题难度:简单
3、选择题 下列关于Na2CO3和NaHCO3的说法不正确的是
A.在水中溶解度:Na2CO3> NaHC O3
B.二者都能与酸反应生成CO2
C.热稳定性:Na2CO3< NaHCO3
D.水溶液的碱性:Na2CO3> NaHCO3
参考答案:C
本题解析:该题考察碳酸钠和碳酸氢钠的性质比较,只有C错误,碳酸氢钠分解生成碳酸钠、水和二氧化碳,碳酸钠比较稳定。
本题难度:简单
4、选择题 除去混在Na2CO3粉末中的少量NaHCO3,下列最合理的方法是
A.加入适量NaOH溶液
B.加热到固体质量不变
C.加入适量HCl溶液
D.加入适量CaCl2溶液
参考答案:B
本题解析:本题考查物质的分离、提纯。熟练掌握相关物质的性质是解题的关键;除杂的原则是:不增、不减、操作易行,即除去杂质不能增加新的杂质,一般不减少被提纯物质的量,操作简便易行。碳酸氢钠不稳定,受热易分解,碳酸钠受热不分解,可用加热的方法除去NaHCO3固体。A、因不能确定NaHCO3的量,加入NaOH的量难以控制,易混入新杂质,错误;B、碳酸氢钠不稳定,受热易分解,碳酸钠受热不分解,可用加热的方法除去NaHCO3固体,正确;C、加入盐酸,Na2CO3和NaHCO3都与盐酸反应氯化钠,违反不减原则,错误;D、加入适量CaCl2溶液,碳酸钠与CaCl2溶液反应生成碳酸钙沉淀,违反不减原则,错误。
本题难度:一般
5、填空题 已知A、B、C、D为常见单质,其中B、C、D常温常压下为气体,甲、乙、丙、丁为化合物,乙常温下为液体,丙的焰色反应为黄色,下图为各种物质之间的相互反应
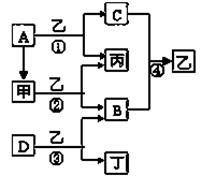
(1)写出下列物质的化学式:
A?,B?,D?,丙?。
(2)丙电子式为?,反应②中若有11.2L(标准状况下)B生成,则发生转移的电
子的物质的量为?。
(3)写出反应③的化学方程式:?
参考答案:(1)A:钠; B: 氧气;C:氟气;丙:氢氧化钠(2)1 mol(3)2F2+2H2O=O2+4HF
本题解析:丙的焰色反应为黄色且为化合物,故丙为NaOH, 乙常温下为液体,又乙由常见的两种单质气体反应生成,故乙为水,根据A和乙反应生成氢氧化钠和氢气,故C为氢气,B为氧气;单质气体与水反应能生成氧气的是氟气,故D为氟气;甲和水生成氢氧化钠和氧气,则甲为过氧化钠;故(1)A:钠; B: 氧气;C:氟气;丙:氢氧化钠;(2)氢氧化钠的电子式为:Na+ [: O : H]-;②反应为2Na2O2+2H2O===4NaOH+O2。故生成0.5mol的氧气发生转移的电子数为1mol。(3)③的化学反应方程式为:2F2+2H2O=O2+4HF。
本题难度:一般