微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)(1)甲烷(CH4)的摩尔质量为 ;
(2)8 g CH4中约含有 个分子、含有 mol电子,在标准状况下所占的体积约为 L;
(3)所含原子数相等的甲烷和氨气(NH3)的质量比为 。
参考答案:(1)16 g/mol;(2)3.01×1023、5,11.2;(3)64:85(3分)(其余均2分)
本题解析:略
本题难度:一般
2、选择题 下列有关阿伏加德罗常数(NA)的说法错误的是
A.常温常压下28克N2所含的原子数目为2NA
B.标准状况下0.5molH2O含有的原子数目为1.5NA
C.任何条件下0.5mol氨气分子的分子数一定是0.5NA
D.49克H2SO4中含有的原子数目为1.5NA
参考答案:D
本题解析:A正确,28克N2的物质的量为1mol含的原子数目为2NA;B正确,0.5molH2O含有的原子数目为1.5NA;C正确,0.5mol氨气分子的分子数一定是0.5NA;D错,49克H2SO4物质的量为0.5mol,含有的原子数目为3.5NA;
本题难度:一般
3、选择题 M(NO3)2热分解化学方程式为:2 M(NO3)2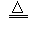 2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
[? ]
A.64g/mol
B.24g/mol
C.65g/mol
D.40g/mol
参考答案:B
本题解析:
本题难度:一般
4、填空题 某同学用NaOH固体配制250mL 2mol/L的NaOH溶液,并进行有关实验。请回答下列问题:
(1)需要称取NaOH固体__________g。
(2)配制该NaOH溶液时使用的仪器除托盘天平(砝码、镊子)、药匙、量筒、250mL容量瓶、胶头滴管外,还必须用到的仪器有__________、__________等。
(3)取所配制的NaOH溶液100mL,与一定质量的铝充分反应,铝全部溶解后,生成的气体在标准状况下的体积为3.36L,则参加反应的铝的质量为__________g,设反应后溶液的体积仍为100mL,则反应后溶液中OH-的物质的量浓度为(不考虑水解)__________。
参考答案:(1)20.0
(2)烧杯;玻璃棒
(3)2.7;1mol/L
本题解析:
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数,下列叙述中正确的是(?)
A.0.1mol·L-1稀硫酸中含有硫酸根离子个数为0.1NA
B.1molCH3+(碳正离子)中含有电子数为10NA
C.标准状况下,0.5NA个NO和0.5NA个O2混合气体的体积约为22.4 L
D.12.4g白磷中含有磷原子数为0.4NA
参考答案:D
本题解析:注意物质的量相关计算公式的熟练应用。
A中考查物质的量浓度概念,由N=n×NA和n = C×V可得,光由已知浓度不能确定溶液中微粒个数,应该还要给出溶液的体积才可以计算,所以A错误;B,要先求出一个CH3+中电子数为6+3-1=8个,所以1molCH3+(碳正离子)中含有电子数为8NA;C中标准状况下, NO和O2混合会发生反应2NO+ O2==2NO2,所以气体的体积不是22.4 L,应为0.75×22.4 L,C错误;D中白磷分子为P4,12.4g白磷的物质的量为0.1mol,所以含有磷原子数为0.4NA,D正确。
点评:学生要熟悉以物质的量为中心的计算公式,并进行细心计算
本题难度:一般