微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关平衡常数的说法中,正确的是( ? )
A.平衡常数为K=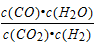 的反应,化学方程式为CO2+H2?CO+H2O
的反应,化学方程式为CO2+H2?CO+H2O
B.反应2NO2(g)?N2O4(g)△H<0,升高温度,该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D.改变条件,反应物的转化率增大,平衡常数也一定增大
参考答案:A
本题解析:
本题难度:简单
2、选择题 反应:
PCl5(g)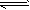 PCl3(g)+Cl2(g)①
PCl3(g)+Cl2(g)①
2HI(g) H2(g)+I2(g)②
H2(g)+I2(g)②
2NO2(g)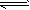 N2O4(g)③
N2O4(g)③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率
[? ]
A.均不变
B.①增大,②不变,③减少
C.均增大
D.①减少,②不变,③增大
参考答案:D
本题解析:
本题难度:一般
3、填空题 (14分)I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________________________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
请完成下列问题。
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。
II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
酸或碱
| 电离平衡常数(Ka或 Kb)
|
CH3COOH
| 1.8×10-5
|
HNO2
| 4.6×10-4
|
HCN
| 5×10-10
|
HClO
| 3×10-8
|
NH3·H2O
| 1.8×10-5
|
请回答下列问题:
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。
参考答案:Ⅰ(1)NO2(g) + CO(g) = CO2(g) + NO(g) △H=—234kJ·mol-1(2分)
(2)① >(1分) ②C(2分) ③ >(2分) Ⅱ、(1)HCN(1分)B(1分)
(2)中性(1分)CH3COOH与NH3·H2O的电离平衡常数相等,可知CH3COO-和NH4+在相等浓度时的水解程度相同(2分) c(NH4+)=c(Cl-) > c(H+)=c(OH-)(2分)
本题解析:Ⅰ、(1)根据图像可知反应物的总能量高于生成物的总能量,因此反应热△H=—368kJ/mol+134kJ/mol=—234kJ/mol,则该反应的热化学方程式为 NO2(g) + CO(g)=CO2(g) + NO(g) △H=—234kJ·mol-1。
(2)①正方应是放热反应,升高温度平衡向逆反应方向进行,则平衡常数减小,因此K1>K2。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此容器内N2、H2、NH3的浓度之比为1:3:2不能说明反应得到平衡状态,a错误;b.v(N2)正=3v(H2)逆不能满足反应速率之比是相应的化学计量数之比,因此不能说明反应达到平衡状态,b错误;c.正方应是体积减小的可逆反应,则压强是减小的,因此容器内压强保持不变可以说明反应达到平衡状态,c正确;d.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终不变,则混合气体的密度保持不变不能说明反应达到平衡状态,d错误,答案选c。
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,即浓度分别是2mol/L、4mol/L、6mol/L,则此时浓度商=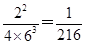 <0.5,则反应向正反应方向进行,因此该反应的v(N2)正大于v(N2)逆。
<0.5,则反应向正反应方向进行,因此该反应的v(N2)正大于v(N2)逆。
Ⅱ、(1)电离常数越小,酸性越弱,因此酸性最弱的是HCN;A.升高温度促进电离,电离常数增大,A错误;B.加水稀释促进电离,温度不变,电离常数不变,B正确;C.加少量的CH3COONa固体抑制醋酸的电离,C错误;D.加少量冰醋酸电离程度减小,D错误,答案选B。
(2)由于CH3COOH与NH3·H2O的电离平衡常数相等因此CH3COO-和NH4+在相等浓度时的水解程度相同,所以溶液显中性。则根据电荷守恒可知 c(NH4+)=c(Cl-)>c(H+)=c(OH-)。
考点:考查热化学方程式书写、平衡状态判断、平衡常数和电离常数应用等
本题难度:一般
4、填空题 当一个______反应进行到正反应速率与逆反应速率______时,反应物和生成物的______不再改变,就达到了平衡状态.对于一定条件下的反应2SO2+O2?2SO3当有2molSO3生成同时也有______mol______生成,则反应达到了平衡状态.
参考答案:化学平衡状态的标志是正逆反应速率相等,特征之一是反应物与生成物的浓度保持不变,化学平衡状态研究的是可逆反应,当一个可逆反应进行到正反应速率与逆反应速率相等时,反应物和生成物的浓度不再改变,就达到了平衡状态.对可逆2SO2+O2?2SO3 当有2mol SO3生成同时有1mol的O2(或2mol SO2)生成,就达平衡状态,故答案为:可逆、相等、浓度、1mol;O2(或2molSO2).
本题解析:
本题难度:一般
5、选择题 下列事实不能用勒夏特列原理解释的是( )
A.用排饱和食盐水法收集Cl2
B.温度控制在450℃有利于二氧化硫的催化氧化
C.增大压强有利于合成氨反应
D.工业制取金属钾?Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
参考答案:A.氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,可以勒夏特列原理解释,故A不选;
B.2SO2(g)+O2(g)?2SO3(g)正反应是放热反应,升高温度平衡向逆反应方向移动,不利用三氧化硫的生成,温度控制在450℃,考虑该温度下反应速率较快、催化剂的活性最高,不能用勒夏特列原理解释,故B选;
C.对N2(g)+3H2(g)?2NH3(g),正反应为气体总物质的量减小的反应,增大压强平衡向正反应方向移动,有利于氨气的合成,可以用勒夏特列原理解释,故C不选;
D.使K成蒸气从反应混合物中分离出来,降低K蒸气的浓度,平衡向正反应方向移动,有利于K的制备,可以用勒夏特列原理解释,故D不选;
故选B.
本题解析:
本题难度:一般