微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
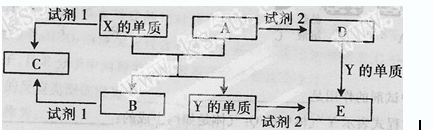
(1)X的单质与A反应的化学方程式是?。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是?
?。
(3)若试剂1和试剂2均是稀硫酸。
①将物质C溶于水,其溶液呈?性(填“酸”、“碱”或“中”)。
②某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式为??。
参考答案:
(1)2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)①酸? ②2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
本题解析:首先观察X和A反应生成B和Y,X、Y是常见金属,而A、B是氧化物,那么此反应就是铝热反应。则X是铝,A氧化铁。所以(1)的方程式可以写出来。(2)若试剂1是氢氧化钠,此反应则为铝和氢氧化钠反应生成偏铝酸钠和氢气、水的反应。(3)①若试剂1是稀硫酸,铝和稀硫酸反应生成C为硫酸铝,溶液呈酸性,因为C为强酸弱碱盐,发生水解显酸性。②E为硫酸亚铁,根据元素守恒,则反应还生成了硫酸钠,配平方程式即可。
点评:本题抓住关键反应进行推断,后面的填空题目不难,只要推断出X、Y是什么金属便可以轻松解答。
本题难度:一般
2、推断题 已知A、B、C是中学化学中的常见物质,它们在一定条件下有如下转化关系
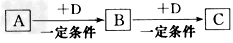
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B的化学反应方程式为________________________
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的化学式为________
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是_____________________ (用必要的文字和离子方程式说明)。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为_____________________。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根离子外还存在的阴离子为_________(填化学式)。
(6)若A、B、C均为氧化物,D是一种黑色固体非金属单质,则B分子的结构式为______________。
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成。则A生成B的化学方程式是__________________。
参考答案:(1)4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)Na2O2
(3)加入少量铁,防止Fe2+被氧化为Fe3+,即2Fe3++Fe=3Fe2+
(4)CO2+CO32-+H2O=2HCO3-
(5)AlO2-{或[Al(OH)4]-)
(6)O=C=O
(7)2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
本题解析:
本题难度:一般
3、填空题 (8分)甲、乙、丙、丁是常见的非金属单质,其中甲、乙、丙是摩尔质量依次增加的气体。气体A和B以物质的量2︰1通入水中,得到C溶液。请根据下图的转化关系回答:
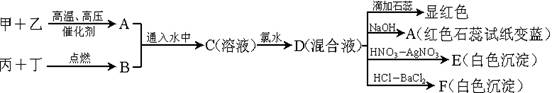
(1)按要求写出下列物质的化学式:
A:??B:??E:??F:?
(2)写出溶液C中加氯水的离子方程式:?
(3)在催化剂和加热条件下,A可与丙反应,化学方程式为:?
参考答案:(8分)
(1)NH3,SO2 ,?AgCl, BaSO4 (各1分)
(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+?(2分)
(3)4NH3+5O2====4NO+6H2O(加热,催化剂)(2分)
本题解析:本题属于无机推断,可以利用倒推法,最后的反应产物的性质可以确定物质的组成;向D溶液中加入NaOH产生了A气体,A气体可以使红色石蕊试纸变蓝,说明A气体是一种碱性气体,中学阶段学习的碱性气体只有氨气,所以A为NH3,又甲和乙化合生成了氨气,可确定甲和乙是氮气和氢气,又甲、乙摩尔质量依次增加,所以甲为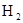 ,乙为
,乙为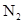 ,向D中加入
,向D中加入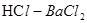 产生白色沉淀F,可判断F为
产生白色沉淀F,可判断F为 ,进而可以确定D中含有硫元素,则可知丙丁中含有硫元素,结合丙为非金属单质气体,丁为非金属单质,可确定丁为硫单质,硫和丙可以点燃,可确定丙为氧气,则B为
,进而可以确定D中含有硫元素,则可知丙丁中含有硫元素,结合丙为非金属单质气体,丁为非金属单质,可确定丁为硫单质,硫和丙可以点燃,可确定丙为氧气,则B为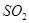 ,气体NH3和
,气体NH3和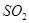 以物质的量2︰1通入水中形成C溶液,则C溶液为
以物质的量2︰1通入水中形成C溶液,则C溶液为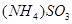 溶液,向
溶液,向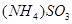 溶液中通入氯水发生氧化还原反应生成
溶液中通入氯水发生氧化还原反应生成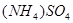 和
和 ,所以D溶液为
,所以D溶液为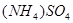 和
和 的混合液; D溶液中含有氯离子,所以E为
的混合液; D溶液中含有氯离子,所以E为 。
。
(1)?A为NH3,B为SO2 E为 F为
F为
(2)?C溶液为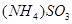 溶液,加入氯水时发生反应的离子反应方程式为
溶液,加入氯水时发生反应的离子反应方程式为
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
(3)催化剂加热条件下,氨气与氧气反应的方程式为4NH3+5O2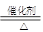 4NO+6H2O
4NO+6H2O
本题难度:一般
4、选择题 (10分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
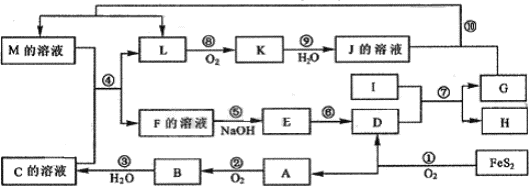
请填写下来空白:
(1)在周期表中,组成单质G的元素位于第?周期第?族。
(2)反应⑦的化学反应方程式为?
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是?(填写序号)
(4)反应④的离子方程式是:?
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:?
参考答案:(1)四(1分)、VIII(1分)
(2)Fe2O3 + 2Al =" 2Fe" + Al2O3(2分)
(3)③(2分)
(4)3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O(2分)
(5)Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O(2分)
本题解析:略
本题难度:简单
5、填空题 已知:下列各种物质都由1~18号元素组成,它们之间的关系如下图所示.
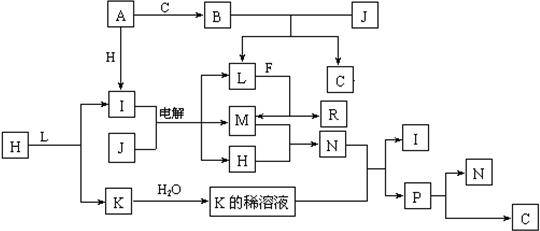
常温下,A、F为金属单质,J是常见无色液体,F既能与L溶液反应,又能与N溶液反应.C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R的焰色反应均呈黄色.R的水溶液中滴加盐酸时,刚开始有白色沉淀,后来沉淀又逐渐溶解.请回答:
(1)请写出A与C反应生成B的化学方程式______
(2)P不稳定光照易分解成N和C,该反应的化学方程式为______
(3)请写出上述电解反应的离子方程式______
(4)R与足量盐酸反应的化学方程式为______.
参考答案:H呈黄绿色,应为Cl2,A、B、I、K、L、R的焰色反应均呈黄色,均含有Na元素,则金属A为Na,与氯气反应生成I为NaCl,钠与气体C反应生成B,B与常见无色液体J反应生成C,可推知J为H2O、C为O2,B为Na2O2,L为NaOH,电解J、I的反应为电解饱和食盐水,则M为H2,金属F与L(NaOH)反应得到R与M(氢气),则F为Al,R为NaAlO2.M(氢气)与H(氯气)反应得到N为HCl,H(氯气)与L(NaOH)反应生成氯化钠、次氯酸钠与水,则K为NaClO,与盐酸反应的I(NaCl)与P,则P为HClO,HClO分解可以得到HCl与氧气,
(1)A与C反应生成B是氧气与钠反应生成过氧化钠,反应方程式为:2Na+O2△.Na2O2,
故答案为:2Na+O2△.Na2O2;
(2)HClO不稳定光照易分解成HCl和氧气,该反应的化学方程式为:2HClO=2HCl+O2↑,
故答案为:2HClO=2HCl+O2↑;
(3)电解饱和食盐水生成氢气、氯气与氢氧化钠,反应的离子方程式为:2H2O+2Cl?电解.2OH?+H2↑+Cl2↑,
故答案为:2H2O+2Cl?电解.2OH?+H2↑+Cl2↑;
(4)偏铝酸钠与足量盐酸反应生成氯化钠、氯化铝与水,化学反应方程式为:NaAlO2+4HCl=AlCl3+NaCl+2H2O,
故答案为:NaAlO2+4HCl=AlCl3+NaCl+2H2O.
本题解析:
本题难度:一般