微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法错误的是( )
A.陶瓷是一种应用广泛的普通硅酸盐材料
B.实验过程中产生的NO2尾气可以用NaOH溶液吸收
C.实验室可用浓硫酸干燥氨气
D.误服重金属盐造成的中毒可服用牛奶解毒
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列常见金属的冶炼原理中不合理的是
?
| 金属
| 冶炼原理
|
A
| Fe
| Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2
|
B
| Hg
| 2HgO 2Hg+O2↑ 2Hg+O2↑
|
C
| Mg
| 2MgO(熔融)  ?2Mg+O2↑ ?2Mg+O2↑
|
D
| Na
| 2NaCl(熔融)  ?2Na+Cl2↑ ?2Na+Cl2↑
|
?
参考答案:C
本题解析:铁的金属性介于中间,一般用还原剂还原,A正确;Hg是不活泼的金属,一般用加热法,B正确;镁是活泼的金属,一般用电解法冶炼,但电解的是熔融的氯化镁,因为氧化镁的熔点高,C不正确;钠是活泼的金属,一般用电解法冶炼,D正确,答案选C。
点评:金属的冶炼一般是依据金属的活泼性选择相应的方法,常见金属冶炼的方法有:1.热分解法:适用于不活泼的金属,如汞可用氧化汞加热制得;2.热还原法:用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原;3.电解法:适用于K、Ca、Na、Mg、Al等活泼金属;4.其他方法:如CuSO4+Fe=Cu+FeSO4。
本题难度:一般
3、填空题 南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为________,原因是___________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换树脂的____________起离子交换作用。当阴离子交换树脂失效后可放入__________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是将海水通过电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
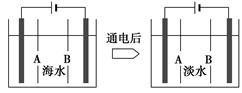
①阳离子交换膜是指__________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_________________________________;
阴极区的现象是:_________________________________________________。
参考答案:(1)永久 (2)先加石灰后加纯碱 过量的钙离子可通过纯碱使之沉淀下来
(3)H+ 强碱
(4)①B ②2Cl--2e-=Cl2↑ 电极上产生无色气体,溶液中出现少量白色沉淀
本题解析:(1)含CaCl2、MgCl2、CaSO2的硬于水属于永久硬水。
(2)先加石灰除去Mg2+,后加纯碱除去过量的Ca2+。
(3)Ca2+、Mg2+与H+交换,阴离子与OH-交换。
(4)阳离子通过阳离子交换膜,在阴极附近,故选B,阳极区是Cl-反应。阴极区2H2O+2e-=H2↑+2OH-,OH-与Mg2+形成Mg(OH)2沉淀。
本题难度:一般
4、实验题 从海水提取镁和溴的流程如下,请回答相关问题。
(1)从海水中提取镁的流程如下图所示(框图中是主要产物):
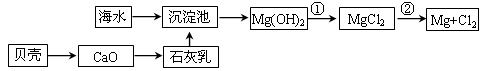
i.海水进入沉淀池前,对海水进行处理有以下两种方案:
方案一:将晒盐后的卤水通入沉淀池;
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案________更合理,理由是_________________________________________。
ii.反应①的离子方程是________________________________________________。
反应②的化学方程式是_______________________________________________。
(2)从海水中提取溴的流程如下图所示(框图中是主要产物):
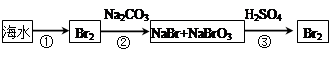

i.过程①中,加入的试剂是___________。
ii.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______________________________________________________________________。
iii.过程③中反应的化学方程式是____________________________________________。
iv.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是__________________________________________________(结合离子方程式回答)。
参考答案:(9分)(1)i. 一?要加热海水需大量的能源,浪费了能源
ii. Mg(OH)2+2H+=Mg2++2H2O ; MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(2)i.? Cl2
ii.温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸汽的逸出
iii.5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O(2分)
iv.加入适量溴化钠,利用有机溶剂将溴分离提纯,Cl2+2Br-=Br2+2Cl-
本题解析:(1)i.由于蒸发浓缩海水需要加热海水,从而消耗大量的能源,浪费了能源,所以方案一最好。
ii.氢氧化镁转化为氯化镁,需要将氢氧化镁溶解在盐酸中,反应的离子方程式是Mg(OH)2+2H+=Mg2++2H2O;镁是活泼的金属,需要电解法冶炼,电解熔融的氯化镁即可生成金属镁和氯气,反应的化学方程式是MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
(2)i.海水中的溴是以溴离子的形成存在的,需要加入氧化剂将其氧化生成单质溴,因此过程①中,加入的试剂是Cl2。
ii.由于温度升高,气体的溶解度减小,另外空气不与溴发生反应,可以搅动液体,有利于溴蒸汽的逸出,因此要吹入热空气。
iii.在酸性条件下,溴酸钠能和溴化钠发生氧化还原反应生成单质溴,反应的化学方程式是5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O。
iv. 氯气具有强氧化性,所以要出去单质溴中的少量氯气,可以加入适量溴化钠,利用有机溶剂将溴分离提纯,反应的离子方程式是Cl2+2Br-=Br2+2Cl-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以海水的综合应用为载体,有利于调动学生的学习兴趣,激发学生的学习求知欲。
本题难度:一般
5、选择题 下列有关物质的用途(括号内为用途),错误的是( )
A.石灰石(实验室制取二氧化碳气体)
B.二氧化硅(制造光导纤维)
C.铁(铁槽车运输浓硫酸)
D.品红溶液(检验二氧化碳气体)
参考答案:D
本题解析:
本题难度:简单