微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
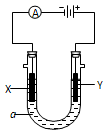
1、填空题 某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。

(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
参考答案:(1)正 C (2)阴离子 阳离子 (3)H2-2e-+2OH-=2H2O (4)49g 6.02×1023
本题解析:题图中左边加入含硫酸的水,暗示左边制硫酸,即OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO42-通过M交换膜向左边迁移,即M为阴离子交换膜,由此推知X为阳极,与电源正极相连,B出口产生氧气,A出口流出硫酸;同理,右侧加入含KOH的水,说明右边制备KOH溶液,H+在Y极发生还原反应,说明Y极为阴极,与电源负极相连,右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜。所以,C出口产生氢气,D出口流出KOH溶液。(3)若将制得的氢气和氧气在氢氧化钾溶液中构成原电池,正极反应式为O2+2H2O+4e-=4OH-,负极反应式为2H2-4e-+4OH-=4H2O。(4)n(H2)=0.5 mol,2H++2e-=H2↑,得电子为1 mol,X极的反应式为4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑,根据电子守恒知,生成H+的物质的量为1 mol,故生成0.5 mol H2SO4,m(H2SO4)=49 g。
本题难度:一般
2、填空题 (16分)电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是?,
在X极附近观察到的现象是?。
②Y电极上的电极反应?,
检验该电极反应产物的方法是?。
(2)若X和Y仍均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为_____
_________________________。通过一段时间后,向所得溶液中加入16gCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________。?
(3)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应式是_________________________。
②Y电极的材料是___________,电极反应式是_________________________。
(说明:杂质发生的电极反应不必写出)
参考答案:(1)①2H+ + 2e—= H2↑ (2分)?有气泡产生,溶液变红色(1分)
②2Cl-—2e—= Cl2↑(2分)?用湿润的淀粉KI试纸(1分)
(2)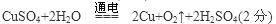 ? 0.4mol(2分)
? 0.4mol(2分)
(3)①精铜(1分),Cu2+ + 2e— =" Cu" (2分)
②粗铜(1分),Cu — 2e— = Cu2+(2分)
本题解析:(1)惰性电极电解饱和食盐水,阳极氯离子放电,生成氯气,电极反应式为2Cl-—2e—= Cl2↑。阴极水电离出的氢离子放电生成氢气,故阴极周围显碱性,电极反应式为2H+ + 2e—= H2↑。根据装置可判断,X是阴极,Y是阳极。氯气具有强氧化性,可以湿润的淀粉KI试纸检验。
(2)惰性电极电解CuSO4溶液时,阳极OH-放电,生成氧气,阴极铜离子放电析出单质铜,总的反应式为CuSO4+2H2O  ?2Cu+O2↑+2H2SO4。16gCuO是0.2mol,这说明反应中析出了0.2mol铜,所以转移电子的物质的量是0.4mol。
?2Cu+O2↑+2H2SO4。16gCuO是0.2mol,这说明反应中析出了0.2mol铜,所以转移电子的物质的量是0.4mol。
(3)粗铜提纯时,粗铜应作阳极,精铜作阴极,硫酸铜溶液作电解液。Y是阳极,X是阴极,所以电极反应式分别为Cu — 2e— = Cu2+、Cu2+ + 2e— = Cu。
本题难度:一般
3、选择题 (2014届江西省九江市七校高三第二次联考化学试卷)
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是(?)

A.当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B.b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH-
C.d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
参考答案:D
本题解析:
由题给装置图可知,左边装置有外加电源,为电解池,右边装置是原电池。电解池中,b电极与外加电源的正极相连,则b为阳极,失电子发生氧化反应:4OH--4e-═2H2O+O2↑;a电极与外加电源的负极相连,则a为阴极,得到电子发生还原反应:2H++2e-═H2↑;燃料电池中是酸性溶液,结合装置图知,d为负极失电子发生氧化反应:H2-2e-═2H+;c电极为正极得到电子发生还原反应:O2+4H++4e-═2H2O。A、根据上述分析知,当有0.1mol电子转移时,a极产生1.12L H2(标准状况下),错误;B、 b极上发生的电极反应是:4OH--4e-═2H2O+O2↑,错误;C、 d极上发生的电极反应是:H2-2e-═2H+,错误;D、c为原电池的正极,阳离子移向正极, c极上进行还原反应,B中的H+可以通过隔膜进入A,正确。
本题难度:一般
4、实验题 碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。

(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为?。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应?;阴极上得到的气体产物为?;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为?,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
?
(4)电解完毕,从电解液中得到KIO3晶体的过程为:

步骤①的操作名称?,步骤④中洗涤晶体的目的?。
参考答案:
(1)5:1
(2)I-+6OH--6e-=IO3-+3H2O?氢气
(3)IO3-+ 5I-+6H+=3I2+3H2O
【实验操作】取少量阳极区电解液于试管中,加稀硫酸酸化后,加入几滴淀粉 溶液,观察是否变蓝
【现象及结论】如果不变蓝,说明没有I-(如果变蓝,说明有I-)
(4)蒸发浓缩,洗去吸附在碘酸钾晶体表面的氢氧化钾等杂质
本题解析:(1)碘元素由0价升为+5价,则I2是还原剂,KIO3是氧化产物,碘元素还由0价降为—1价,则I2还是氧化剂,KI是还原产物;根据系数之比等于物质的量之比,由于氧化产物KIO3为1mol,则还原剂I2为1/2mol,还原产物KI为5mol,则氧化剂I2为5/2mol,所以该反应中氧化剂和还原剂的物质的量之比为5/2∶1/2=5∶1;(2)阳极发生氧化反应,根据题意可知其主要反应物和产物是I―→IO3―;碘元素由—1价升为+5价,根据化合价升高总数等于失去电子数可知,I―—6e―→IO3―;根据KOH溶液显碱性可知,应用OH―使左右电荷守恒,则I―—6e―+6OH―→IO3―;根据氢或氧原子个数守恒可知,I―—6e―+6OH―=IO3―+3H2O;溶液中的阳离子移向阴极,H+优先得到电子,发生还原反应,产生氢气,则阴极得到的气体产物是H2;(3)碘元素由+5价降为0价,说明KIO3是氧化剂,I2是还原产物,碘元素由—1价升为0价,说明I―是还原剂,I2还是氧化产物;根据化合价升降总数相等,则IO3―+5I―→3I2;酸性介质中可用H+使左右电荷守恒,则IO3―+5I―+6H+→3I2;根据氢或氧原子守恒可知,该反应为IO3―+5I―+6H+=3I2+3H2O;检验阳极区电解液中I―时,需要借助上述反应中碘离子的氧化产物(碘单质)遇淀粉变蓝的特性,就是要设法使碘离子转化为碘单质;因此实验时先取少量阳极区电解液于试管中,加稀硫酸酸化后,再加入几滴淀粉溶液,观察是否变蓝,若不变蓝,说明无碘离子;若变蓝,说明有碘离子;(4)根据混合物分离提纯的方法可知,从KIO3溶液中制KIO3晶体的过程分别为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则步骤①为蒸发浓缩;KIO3晶体上吸附着KOH等易溶性杂质,洗涤的目的是除去晶体表面吸附的易溶性杂质。
本题难度:困难
5、填空题 电解原理在化学工业中有广泛应用。右图表示一个电解池,

装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①Y电极上的电极反应式为?,
检验该电极反应产物的方法是?。
②电解池中X极上的电极反应式为?。
在X极附近观察到的现象是?。
③电解一段时间后,若收集到H2为2L,则同样条件下收集的Cl2?2L(填“>”“<”“=”),
原因是?。
(2)如果在铁件的表面镀铜防止铁被腐蚀,电解液a选用CuSO4溶液,请回答:
①X电极对应的金属是____?__(写元素名称),其电极反应式?。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
?。
参考答案:⑴①2H+ + 2e - = H2↑?放出气体,溶液变红。
②2Cl -?- 2e - = Cl2 ↑?把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
③<,电解生成的Cl2与电解生成的NaOH发生了反应
⑵①铜? Cu2+ + 2e- ="=" Cu
②0.08 mol
③铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀。(其他答案合理也给分
本题解析:⑴结合溶液中离子的放电顺序容易判断写出阴阳两极的反应式,同时注意回答实验现象要全面。电解氯化钠溶液时,理论上在两极上产生的氢气和氯气的体积相等,因为氯气与生成的NaOH溶液反应一部分,因此,实际上生成的氯气体积小于氢气体积。
⑵①电镀时,待镀金属作阴极,镀层金属作阳极,故X电极应为铁。②据电镀时两极的反应式:阳极:Cu - 2e - = Cu2+,阴极:Cu2+ + 2e - = Cu,可以分析出阳极溶解2.56克铜,阴极增重2.56克铜,故转移电子数为0.08mol. ③利用原电池原理去分析。
本题难度:一般