微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列气体溶于水,发生氧化还原反应的是
A.SO2溶于水
B.NO2溶于水
C.CO2溶于水
D.NH3溶于水
参考答案:B
本题解析:SO2溶于水生成亚硫酸,是非氧化还原反应。B中NO2溶于水生成NO和硝酸,是氧化还原反应。C中CO2溶于水,生成碳酸,是非氧化还原反应。氨气溶于水生成一水合氨,是非氧化还原反应,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查,试题基础性强,主要是考查学生对常见气体性质以及氧化还原反应判断的熟悉掌握程度,有利于培养学生的逻辑推理能力,通过学生的应试能力。
本题难度:简单
2、填空题 (8分)含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为_______________,
②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。写出该反应的离子方程式:_________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如右图所示的A和B曲线,试回答下列问题:
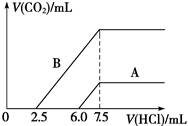
①_______曲线正确,天然碱的化学式为___________,
③加盐酸后产生CO2气体体积(标准状况)的最大值为_________________mL。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。
亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数是________。
参考答案:(1)①NaHCO3 (1分)?②2MnO+5H2O2+6H+===2Mn2++8H2O+5O2↑(2分)
(2)B; (1分) ? Na2CO3·NaHCO3·2H2O,(1分)? 112(1分)? (3)6.02×1023(1分)
本题解析:(1)①根据原子守恒可知A应该是碳酸氢钠。
②H2O2→ O2,说明双氧水是还原剂,所以MnO4-是氧化剂,则方程式为2MnO+5H2O2+6H+===2Mn2++8H2O+5O2↑。
(2)由于碳酸钠和盐酸反应是分步进行的,即Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。因此在含有碳酸氢钠的条件下,生成CO2时消耗的盐酸多,即B曲线正确;根据图像可知,和碳酸钠反应的盐酸时2.5ml,所以和原碳酸氢钠反应的盐酸是7.5ml-2.5ml-2.5ml=2.5ml,因此a和b的比值是1︰1的,则化学式为Na2CO3·NaHCO3·2H2O;根据图像可知生成CO2时消耗的盐酸是5ml,所以生成CO2是0.005mol,标准状况下的体积是0.112L。
(3)HClO2中氯元素的化合价是+3价,反应后部分升高到+4价,所以当有1 mol ClO2生成时转移的电子是1mol,个数是6.02×1023。
本题难度:一般
3、选择题 将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是
[? ]
A.Fe(NO3)x中的x为2
B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移
C.稀HNO3在反应中只作氧化剂
D.磁性氧化铁中的铁元素全部被氧化
参考答案:B
本题解析:
本题难度:一般
4、选择题 亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2.酸性KMnO4溶液与亚硝酸钠发生的离子反应为:MnO+NO+H+―→Mn2++NO+H2O(未配平),下列叙述错误的是(? )
A.生成1 mol Mn2+,转移电子为5 mol
B.该反应中氮元素被氧化
C.配平后,水的化学计量数为3
D.反应中氧化产物与还原产物的物质的量之比为2∶5
参考答案:D
本题解析:
2MnO+5NO+6H+=2Mn2++5NO+3H2O,A、正确,生成1 mol Mn2+,变5价,转移电子为5 mol; B.正确,该反应中氮元素化合价升高,被氧化; C.正确; D.反应中氧化产物与还原产物的物质的量之比为5∶2,选D。
本题难度:一般
5、选择题 &nbs p;金属铜的提炼多从黄铜矿(CuFeS2)开始,已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中发生的主要反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
A.SO2既是氧化产物又是还原产物
B.CuFeS2既是氧化剂又是还原剂
C.O2只做氧化剂
D.若有1mol O2参加反应,则反应中有4mol电子转移
参考答案:D
本题解析:A正确,氧化产物由还原剂生成,还原产物由氧化剂生成;B正确,CuFeS2在反应的过程中既有元素化合价升高又有元素化合价降低,所以既是氧化剂又是还原剂;
C正确,氧气在反应中元素化合价只降低;D错,若有1mol O2参加反应,则反应中电子转移数大于4mol;
本题难度:一般